Hiệu giá của kháng thể kháng sởi của globulin miễn dịch người không đặc hiệu được xác định bằng kỹ thuật gì?
Globulin miễn dịch người là gì?
Globulin miễn dịch người được giải thích tại Mục 4 Tiêu chuẩn quốc gia TCVN I-5:2017 như sau:
Globulin miễn dịch người là chế phẩm dạng lỏng hoặc đông khô có chứa các globulin miễn dịch, chủ yếu là IgG từ huyết tương người bình thường.
Globulin miễn dịch ở dạng lỏng là dung dịch trong suốt, không màu hoặc có màu nâu-vàng nhạt.
Globulin miễn dịch đông khô là bột màu trắng hoặc vàng nhạt, có dạng khối xốp, mịn.
Globulin miễn dịch người không đặc hiệu được chỉ định dùng để điều trị phòng ngừa nhiễm viêm gan A, viêm gan B, sởi, rubella... hoặc trong các trường hợp bị thiếu hụt globulin gamma, các trường hợp đang điều trị ức chế miễn dịch, bị nhiễm trùng nhưng kháng thuốc kháng sinh.
Theo đó, globulin miễn dịch người là chế phẩm dạng lỏng hoặc đông khô có chứa các globulin miễn dịch, chủ yếu là IgG từ huyết tương người bình thường.
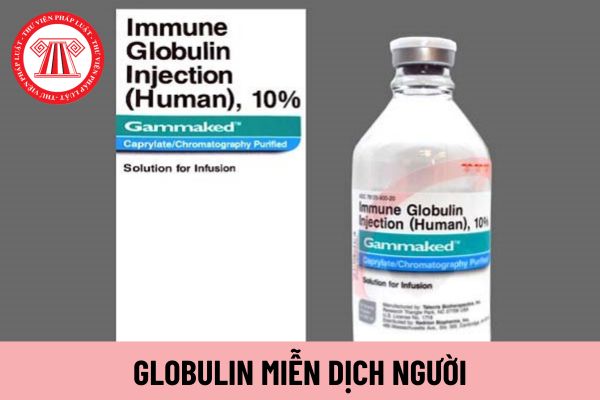
Globulin miễn dịch người là gì? (Hình từ Internet)
Sản xuất Globulin miễn dịch người được quy định như thế nào?
Sản xuất Globulin miễn dịch người được quy định tại Mục 4 Tiêu chuẩn quốc gia TCVN I-5:2017 như sau:
Sản xuất
Globulin miễn dịch được điều chế từ huyết tương của tối thiểu 1000 người. Huyết tương nguồn có thể được chiết tách trực tiếp từ máu người hoặc từ huyết tương đông băng có chứa không ít hơn 0,1 đơn vị kháng độc tố bạch hầu hoặc kháng độc tố uốn ván và không ít hơn 0,25 đơn vị kháng thể kháng sởi. Phần có chứa globulin miễn dịch lớp G được phân tách bằng phương pháp sắc ký cột sao cho không làm hỏng các cấu trúc kháng thể, đảm bảo ngăn ngừa sự lan truyền của các virus viêm gan và các vi sinh vật khác, nồng độ của globulin miễn dịch phải đạt 50 g/l với nhiều loại kháng thể khác nhau và ít nhất 2 trong số đó (một loại kháng vi khuẩn và một loại kháng virus) phải có nồng độ cao hơn tối thiểu gấp 3 lần so với nồng độ ban đầu. Các chất bảo quản kháng vi sinh vật hoặc chất ổn định có thể được sử dụng nhưng không được làm ảnh hưởng đến hiệu giá của các kháng thể.
Theo đó, Globulin miễn dịch được điều chế từ huyết tương của tối thiểu 1000 người.
Huyết tương nguồn có thể được chiết tách trực tiếp từ máu người hoặc từ huyết tương đông băng có chứa không ít hơn 0,1 đơn vị kháng độc tố bạch hầu hoặc kháng độc tố uốn ván và không ít hơn 0,25 đơn vị kháng thể kháng sởi.
Phần có chứa globulin miễn dịch lớp G được phân tách bằng phương pháp sắc ký cột sao cho không làm hỏng các cấu trúc kháng thể, đảm bảo ngăn ngừa sự lan truyền của các virus viêm gan và các vi sinh vật khác, nồng độ của globulin miễn dịch phải đạt 50 g/l với nhiều loại kháng thể khác nhau và ít nhất 2 trong số đó (một loại kháng vi khuẩn và một loại kháng virus) phải có nồng độ cao hơn tối thiểu gấp 3 lần so với nồng độ ban đầu.
Các chất bảo quản kháng vi sinh vật hoặc chất ổn định có thể được sử dụng nhưng không được làm ảnh hưởng đến hiệu giá của các kháng thể.
Hiệu giá của kháng thể kháng sởi của globulin miễn dịch người không đặc hiệu được xác định bằng kỹ thuật gì?
Hiệu giá của kháng thể kháng sởi của globulin miễn dịch người không đặc hiệu được xác định bằng kỹ thuật được quy định tại Mục 4 Tiêu chuẩn quốc gia TCVN I-5:2017 như sau:
Hiệu giá
Hiệu giá của kháng độc tố bạch hầu hoặc kháng độc tố uốn ván
Hiệu giá của kháng độc tố bạch hầu: Phụ lục 15.15.
Hiệu giá của kháng độc tố uốn ván: Phụ lục 15.16.
Tiêu chuẩn đánh giá: Hàm lượng kháng độc tố bạch hầu hoặc kháng độc tố uốn ván không nhỏ hơn 2 IU/ml mẫu thử nghiệm.
Hiệu giá của kháng thể kháng sởi
Hiệu giá của kháng thể kháng sởi của globulin miễn dịch người không đặc hiệu được xác định bằng kỹ thuật trung hòa trên tế bào Vero và tính bằng số đơn vị quốc tế trong 1ml (IU/ml).
Vật liệu:
Mẫu thử nghiệm: Globulin miễn dịch người.
Mẫu chuẩn quốc tế.
Huyết thanh bào thai bê.
Tế bào Vero
Virus sởi giảm độc lực để trung hòa.
Môi trường 199 có chứa 2 % huyết thanh bào thai bê.
Trypsin 0,25 %.
Phiến nhựa nuôi tế bào 96 giếng, đáy bằng.
Tiến hành: Tiến hành đồng thời trên 2 phiến cho 1 lần thử nghiệm.
Phiến 1:
Pha loãng mẫu chuẩn và mẫu thử nghiệm với môi trường 199 để có dung dịch chứa 5 IU/ml.
Tiếp tục pha loãng bậc 2 liên tiếp từ dung dịch pha loãng trên của mẫu thử nghiệm và mẫu chuẩn để có các dung dịch 2-1; 2-2; 2-3;... đến 2-12
Pha virus sởi trung hòa bằng môi trường 199 để có dung dịch chứa 100 CCID50/50 µl (Cell Culture Infectious Dose-Liều gây hủy hoại 50 % tế bào).
Nhỏ 50 µl từ mỗi dung dịch đã pha loãng của mẫu thử nghiệm và mẫu chuẩn ở các độ pha từ 2-6 đến 2-12 vào 7 giếng theo sơ đồ bố trí trên phiến trước.
Nhỏ 50 µl dung dịch virus trung hòa.
Để ở tủ ấm 37 °C, 5 % CO2 trong vòng 60 min đến 90 min.
Nhỏ 100 µl dung dịch tế bào có nồng độ 2 x 105/ml.
Để ở tủ ấm 37 °C, 5 % CO2 trong 7 ngày đến 9 ngày.
Theo dõi CPE dưới kính hiển vi.
Tính kết quả:
Tính số CCID50/50 µl để trung hòa trong thử nghiệm.
Tính theo công thức Kaber:
Log CCID50 = -log C - [(Tổng số % hủy hoại ở các nồng độ/100 - 0,5) x log d]
trong đó:
CCID50 là liều virus gây hủy hoại 50 % tế bào;
C là nồng độ virus cao nhất dùng trong thử nghiệm;
% biến đổi là tỷ lệ giữa số giếng có sự biến đổi tế bào và tổng số giếng của một độ pha;
d là hệ số (bậc) pha loãng.
Tiêu chuẩn đánh giá: Số CCID50/50 µl phải nằm trong khoảng dao động từ 31 đến 316.
Tính liều bảo vệ 50 % tế bào
Tính theo công thức Karber hoặc Reed-Muench:
Log ED50 = -log C - [(Tổng số % hủy hoại ở các nồng độ/100 - 0,5) x log d]
trong đó:
ED50 là liều bảo vệ 50 % tế bào;
C là độ pha loãng thấp nhất của mẫu thử hoặc mẫu chuẩn quốc tế dùng trong thử nghiệm;
% bảo vệ là tỷ lệ giữa số giếng có tế bào được bảo vệ và tổng số giếng của một độ pha;
d là hệ số (bậc) pha loãng.
Tính hiệu giá
HG (IU/ml) = (ED50 của mẫu chuẩn/ED50 của mẫu thử nghiệm) x 5 (IU)
Tiêu chuẩn đánh giá: Hiệu giá của kháng thể kháng sởi phải không được nhỏ hơn 5 IU/ml globulin miễn dịch người không đặc hiệu.
...
Như vậy, hiệu giá của kháng thể kháng sởi của globulin miễn dịch người không đặc hiệu được xác định bằng kỹ thuật trung hòa trên tế bào Vero và tính bằng số đơn vị quốc tế trong 1ml (IU/ml).










Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.
- Biển R411 là biển gì? Lỗi R411 là gì? Lỗi R411 xe ô tô bị phạt bao nhiêu tiền 2025 theo Nghị định 168? Vạch 9.3 là gì?
- Viết thư cho bạn kể về ước mơ của em lớp 4? Học sinh lớp 4 cần đạt yêu cầu về kỹ năng về đọc trong Chương trình Ngữ văn như thế nào?
- Lời dẫn MC đám cưới hay, hài hước? Tiền mừng cưới nhận được từ công ty có phải chịu thuế TNCN không?
- Mẫu Biên bản bầu Bí thư, Phó bí thư đảng bộ mới nhất là mẫu nào? Nội dung biên bản bao gồm những gì?
- Có được tặng cho biển số xe trúng đấu giá không? Quyết định xác nhận biển số xe trúng đấu giá được cấp khi nào?










