Danh mục thuốc biệt dược gốc đợt 2 năm 2024? Cơ quan nào có thẩm quyền công bố danh mục biệt dược gốc?
Danh mục thuốc biệt dược gốc đợt 2 năm 2024?
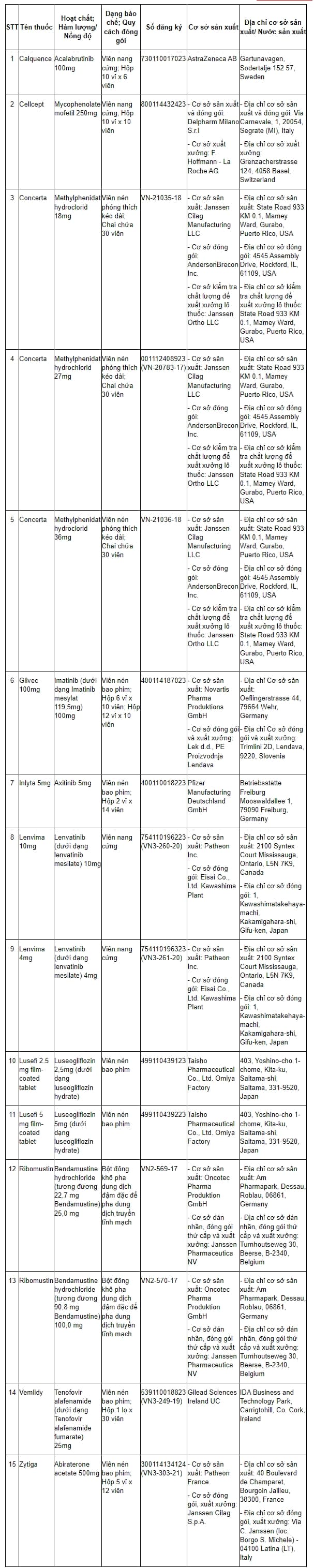
Danh mục thuốc biệt dược gốc đợt 2 được ban hành kèm theo Quyết định số 140/QĐ-QLD năm 2024 như sau:
Biệt dược gốc là gì?
Tại khoản 16 Điều 2 Luật Dược 2016 quy định về biệt dược gốc như sau:
Điều 2. Giải thích từ ngữ
Trong Luật này, các từ ngữ dưới đây được hiểu như sau:
...
16. Biệt dược gốc là thuốc đầu tiên được cấp phép lưu hành trên cơ sở có đầy đủ dữ liệu về chất lượng, an toàn, hiệu quả.
...
Như vậy, biệt dược gốc là thuốc đầu tiên được cấp phép lưu hành trên cơ sở có đầy đủ dữ liệu về chất lượng, an toàn, hiệu quả.

Danh mục thuốc biệt dược gốc đợt 2 năm 2024? (Hình từ Internet)
Tiêu chí phân loại thuốc biệt dược gốc?
Tại Điều 9 Thông tư 08/2022/TT-BYT quy định về tiêu chí phân loại biệt dược gốc như sau:
- Thuốc được cấp giấy đăng ký lưu hành tại Việt Nam được phân loại là biệt dược gốc, sinh phẩm tham chiếu khi đáp ứng đồng thời các tiêu chí sau:
+ Có đầy đủ dữ liệu lâm sàng về an toàn, hiệu quả theo quy định tại Điều 13 Thông tư 08/2022/TT-BYT;
Riêng sinh phẩm tham chiếu, phải có đầy đủ hồ sơ, dữ liệu về chất lượng, tiền lâm sàng, lâm sàng theo hướng phát triển một sản phẩm sinh học từ đầu, không phải phát triển theo hướng tương tự sinh học;
+ Được cấp phép lưu hành bởi một trong các cơ quan quản lý quy định tại khoản 9 Điều 2 Thông tư 08/2022/TT-BYT, trừ thuốc mới sản xuất tại Việt Nam.
- Đối với thuốc đã được Bộ Y tế công bố biệt dược gốc, sinh phẩm tham chiếu sau đó đặt gia công hoặc chuyển giao công nghệ sản xuất một, một số hoặc toàn bộ các công đoạn tại cơ sở sản xuất thuốc tại Việt Nam phải bảo đảm thuốc đã công bố biệt dược gốc, sinh phẩm tham chiếu và thuốc gia công hoặc chuyển giao công nghệ sản xuất tại Việt Nam đáp ứng đồng thời các tiêu chí sau:
+ Cùng công thức bào chế;
+ Cùng quy trình sản xuất;
+ Cùng tiêu chuẩn chất lượng nguyên liệu;
+ Cùng tiêu chuẩn chất lượng thuốc thành phẩm;
Trường hợp có thay đổi một trong các tiêu chí tại điểm b khoản 1 Điều 9 Thông tư 08/2022/TT-BYT hoặc các thay đổi khác liên quan đến chất lượng của thuốc, các thay đổi này phải được phê duyệt bởi cơ quan quản lý dược nước sản xuất hoặc cơ quan quản lý quy định tại khoản 9 Điều 2 Thông tư 08/2022/TT-BYT đã cấp phép lưu hành thuốc đó hoặc cơ sở đăng ký phải cung cấp dữ liệu chứng minh thuốc sản xuất tại Việt Nam tương đương về chất lượng so với biệt dược gốc, sinh phẩm tham chiếu trước khi gia công hoặc chuyển giao công nghệ.
- Thuốc đã được công bố là biệt dược gốc, sinh phẩm tham chiếu có thay đổi cơ sở sản xuất thì thuốc được cấp giấy đăng ký lưu hành mới của cơ sở sản xuất thay đổi cũng được phân loại là biệt dược gốc, sinh phẩm tham chiếu trên cơ sở có đề nghị bằng văn bản của cơ sở đăng ký nếu đáp ứng đồng thời các tiêu chí sau đây:
+ Thuốc được cấp phép lưu hành bởi một trong các cơ quan quản lý quy định tại khoản 9 Điều 2 Thông tư 08/2022/TT-BYT;
+ Thuốc đáp ứng đồng thời các tiêu chí quy định tại điểm b khoản 1 Điều 9 Thông tư 08/2022/TT-BYT.
Trường hợp có thay đổi một trong các tiêu chí tại điểm b khoản 1 Điều 9 Thông tư 08/2022/TT-BYT hoặc các thay đổi khác liên quan đến chất lượng của thuốc, các thay đổi này phải được phê duyệt bởi cơ quan quản lý dược nước sản xuất hoặc cơ quan quản lý quy định tại khoản 9 Điều 2 Thông tư 08/2022/TT-BYT đã cấp phép lưu hành thuốc đó hoặc cơ sở đăng ký phải cung cấp dữ liệu chứng minh thuốc sản xuất tại cơ sở mới tương đương về chất lượng so với biệt dược gốc, sinh phẩm tham chiếu trước khi thay đổi cơ sở sản xuất.
Cơ quan nào có thẩm quyền công bố danh mục biệt dược gốc?
Theo quy định tại Điều 34 Thông tư 08/2022/TT-BYT quy định như sau:
Điều 34. Thẩm quyền cấp, gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc
1. Cục Quản lý Dược và các đơn vị do Bộ trưởng Bộ Y tế quyết định (sau đây gọi tắt là đơn vị thẩm định) tổ chức thẩm định hồ sơ cấp, gia hạn, thay đổi bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, trừ trường hợp quy định tại điểm b khoản 2 Điều này.
2. Cục Quản lý Dược:
a) Cấp, gia hạn, phê duyệt thay đổi, bổ sung giấy đăng ký lưu hành thuốc, công bố biệt dược gốc, sinh phẩm tham chiếu, thuốc có báo cáo nghiên cứu tương đương sinh học trên cơ sở ý kiến tư vấn của Hội đồng đối với từng trường hợp cụ thể hoặc chủ trương chung của Hội đồng áp dụng cho từng loại hình thay đổi, bổ sung, trừ trường hợp quy định tại điểm b khoản này;
b) Công bố trên trang thông tin điện tử của Cục Quản lý Dược nội dung thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với thay đổi nhỏ chỉ yêu cầu thông báo (Notification).
Như vậy, Cục Quản lý dược là cơ quan công bố danh mục biệt dược gốc.
Trân trọng!






Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.
- 05 điều Bác Hồ dạy thiếu niên, nhi đồng? Đoàn Thanh niên có trách nhiệm hướng dẫn thiếu nhi làm theo 5 điều Bác Hồ dạy hay không?
- Vào thi Vòng 7 Trạng nguyên Tiếng Việt 2024 – 2025 trên Trangnguyen.edu.vn như thế nào?
- Tháng 12 2024 có ngày lễ, sự kiện gì? Tháng 12 2024 nước ta có ngày lễ lớn nào không?
- Tổng hợp văn bản hướng dẫn Luật Hôn nhân và gia đình mới nhất?
- Biểu mẫu báo cáo của tổ chức tư vấn hồ sơ chào bán trái phiếu riêng lẻ mới nhất?








