|
MINISTRY OF
HEALTH OF VIETNAM
-------
|
SOCIALIST
REPUBLIC OF VIETNAM
Independence – Freedom – Happiness
----------------
|
|
No.
05/2022/TT-BYT
|
Hanoi, August 01,
2022
|
CIRCULAR
ELABORATING
DECREE NO. 98/2021/ND-CP DATED NOVEMBER 8, 2021 OF THE GOVERNMENT ON MANAGEMENT
OF MEDICAL DEVICES
Pursuant to Decree No. 75/2017/ND-CP dated
June 20, 2017 of Government on functions, tasks, powers, and organizational
structure of Ministry of Health;
Pursuant to Decree No. 98/2021/ND-CP dated
November 08, 2021 of the Government on management of medical devices;
At the request of Director of Department of
Medical Equipment and Construction;
Minister of Health promulgates Circular
elaborating Decree No. 98/2021/ND-CP dated November 8, 2021 of the Government
on management of medical devices.
Article 1. Scope
1. This Circular elaborates Decree No.
98/2021/ND-CP dated November 8, 2021 of the Government on management of medical
devices (hereinafter referred to as “Decree No. 98/2021/ND-CP”).
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
b) Addition to the list of in vitro
diagnostic medical devices that are not required to undergo quality inspection
by Vietnam’s competent authorities under Point dd Clause 3 Article 30 of Decree
No. 98/2021/ND-CP ;
c) List of class B, class C, and class D
medical devices purchased and sold as common commodities mentioned under Clause
1 Article 42 of Decree No. 98/2021/ND-CP ;
d) List of medical devices to be inspected
for safety and technical functions under Clause 10 Article 70 of Decree No.
98/2021/ND-CP ;
dd) List of medical devices to be granted
import permit under Point d Clause 2 Article 76 of Decree No. 98/2021/ND-CP.
2. Annuls documents on management of
medical devices.
Article 2. Regulations
on classification of medical devices
1. A medical device or multiple medical
devices shall be classified in order to determine level of risks and be granted
registration number.
2. The classification of a medical device
or multiple medical devices must rely on the rules for classification using A,
B, C, D levels of risks (details are prescribed under Appendix I attached
hereto).
3. Sample of medical device classification
results shall conform to Appendix II hereof.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
1. Granted Certificate of Free Sale by any
of the following countries, organizations:
a) Food and Drug Administration (FDA) -
United States of America;
b) Therapeutic Goods Administration (TGA) -
Australia;
c) Health Canada;
d) Ministry of Health, Labour and Welfare
(MHLW) - Japan;
dd) Pharmaceuticals and Medical Devices
Agency (PMDA) - Japan;
e) National Medical Products Administration
(NMPA) - China;
g) Ministry of Food & Drug Safety
(MFDS) - Korea;
h) EU member states as per Regulation (EU)
2017/746 of the European Parliament and of the Council of 5 April 2017 on in
vitro diagnostic medical devices.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
3. Other than in vitro reagents,
calibrators, control materials.
Article 4. List of
class B, class C, and class D medical devices purchased and sold as common
commodities mentioned under Clause 1 Article 42 of Decree No. 98/2021/ND-CP
1. Personal blood pressure monitors.
2. Fingertip pulse oximeter (SpO2).
3. Baby nasal aspirators.
4. Electronic thermometers, infrared
thermometers.
5. Medical devices used to measure blood
glucose: blood glucose monitoring device, lancing device, test strip, lancet,
control solution, calibrators.
6. Nebulizers.
7. Medical tape, gauze pads.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
9. Condoms.
10. Vaginal contraceptive film (contains no
drugs).
11. Vaginal lubricants classified as
medical devices.
12. Electrical heating and cooling packs.
13. Class B in vitro diagnostic (ivd)
medical device for self-testing.
14. In vitro diagnostic (ivd) medical
device for self-testing of HIV, SARS-CoV-2.
Article 5. List of
medical equipment to be inspected for safety and technical functions under
Clause 10 Article 70 of Decree No. 98/2021/ND-CP
1. Ventilators.
2. Anaesthetic machines.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
4. Infant incubators.
5. Defibrillators.
6. Hemodialysis machines.
Article 6. List of
medical equipment to be granted import permit under Point d Clause 2 Article 76
of Decree No. 98/2021/ND-CP
1. X-ray imaging devices.
2. Magnetic resonance systems.
3. Diagnostic ultrasound equipment.
4. Diagnostic endoscopy system.
5. Cyclotron system.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
7. Autorefractors, ophthalmometers.
8. Electrophysiology equipment (EEG, ECG,
EMG machines).
9. Electroretinography machines.
10. Bone densitometer.
11. Optical coherence tomography (OCT)
machine; Non-mydriatic retinal camera.
12. Doppler fetal monitors.
13. Spirometers.
14. Biochemistry analyzers; Blood gas and
electrolyte analyzers.
15. Hematology analyzers; Blood type
analysis instruments.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
17. ELISA test system.
18. Cellular extraction system.
19. Platelet aggregation and platelet
function analyzers.
20. Microbial identification instruments.
21. Immunoassay analyzers.
22. In vitro reagents, calibrators, and
controlled materials.
23. Treatment devices using X-ray.
24. Endoscopic surgical system.
25. Radiotherapy equipment (Cobalt machine,
Linear accelerator for cancer treatment, Gamma Knife, Brachytherapy equipment
of all kinds).
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
27. Infusion pump; Electric syringe pump.
28. Scalpel (high voltage current, laser,
ultrasound).
29. Surgical microscopes.
30. Prostatectomy surgery set.
31. Heart–lung machines.
32. Surgical navigation equipment.
33. Cryosurgery devices.
34. Infant incubators; Heaters for infants.
35. Anaesthetic machines.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
37. Implantable
cardioverter-defibrillators.
38. Hyperbaric oxygen therapy chambers.
39. Extracorporeal/intracorporeal shock
wave lithotripsy.
40. High Intensity Focused Ultrasound
(HIFU) system.
41. Hemofiltration devices.
42. Ophthalmology surgical system (Laser
Excimer, Phemtosecond Laser, Phaco, Vitreous cutter, Microkeratomes).
43. Glasses, contact lenses (myopia,
hyperopia, mixed astigmatism) and contact lens solutions.
44. Laser devices for treatment in
ophthalmology.
45. Long-term implantable devices and
instrument (more than 30 days).
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Article 7. Entry
into force
1. This Circular comes into force from
August 01, 2022.
2. Provisions elaborating Decree No.
98/2021/ND-CP under this Circular comes into force from the effective date of
Decree No. 98/2021/ND-CP.
3. Form No. 13.01, Form No. 13.02 under
Appendix I and Form under Appendix V of Circular No. 19/2021/TT-BYT dated
November 16, 2021 of the Minister of Health expire from the effective date
hereof.
4. The following documents expire from
January 1, 2022:
a) Circular No. 39/2016/TT-BYT dated
October 28, 2016 of the Minister of Health;
b) Circular No. 46/2017/TT-BYT dated
December 15, 2017 of the Minister of Health;
c) Circular No. 33/2020/TT-BYT dated
December 31, 2020 of the Minister of Health;
d) Clause 1 Article 1 of Circular No.
23/2021/TT-BYT dated December 9, 2021 of the Minister of Health.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
1. For medical devices specified under
Clauses 1, 2, and 3 Article 5 of this Circular:
a) In case these medical devices are
procured after December 31, 2022, they must undergo safety and technical inspection
as prescribed by Minister of Health;
b) In case these medical devices are
procured before January 1, 2023, they must be adequately inspected before June
1, 2023 in accordance with the procedures promulgated by the Minister of
Health.
2. For medical devices specified under
Clauses 4, 5, and 6 Article 5 of this Circular:
a) In case these medical devices are
procured after December 31, 2023, they must undergo safety and technical
inspection as prescribed by Minister of Health;
b) In case these medical devices are
procured before January 1, 2024, they must be adequately inspected before June
1, 2024 in accordance with the procedures promulgated by the Minister of
Health.
Article 9.
Organizing implementation
Chief of the Ministry Office, Chief Ministry
Inspectorates, Directors, General Directors affiliated to the Ministry of
Health, Directors of Departments of Health of provinces and central-affiliated
cities and other relevant organizations and individuals are responsible for the
implementation of this Circular.
Difficulties that arise during the
implementation of this Circular should be reported to the Ministry of Health
for consideration./.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
PP. MINISTER
DEPUTY MINISTER
Do Xuan Tuyen
APPENDIX I
CLASSIFICATION OF MEDICAL DEVICES
(Promulgated together with Circular No. 05/2022/TT-BYT dated August 01, 2022 of
the Minister of Health)
Section 1
RULES FOR CLASSIFICATION OF MEDICAL DEVICES
Part I
DEFINITIONS
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
1. Active medical
device means any medical device, operation of which depends on a source of
electrical energy or any source of power other than that directly generated by
the human body or gravity and which acts by converting this energy. Medical devices intended
to transmit energy, substances or other elements to between an active medical
device and the patients, without any significant change, are not considered to
be active medical devices.
2. Active therapeutic
device means any medical device, whether used alone or in combination with
other medical devices, to support, modify, replace or restore biological
functions or structures with a view to treatment or alleviation of an illness,
injury or handicap.
3. Active device
intended for diagnosis means any medical device, whether used alone or in
combination with other devices, to supply information for detecting,
diagnosing, monitoring or to support in treating physiological conditions,
states of health, illnesses or congenital deformities.
4. Body orifice means
any natural opening in the body, as well as the external surface of the
eyeball, or any permanent artificial opening, such as a stoma or permanent
tracheotomy.
5. Central
circulatory system means the major intern blood vessels including the
following:
a) Pulmonary artery
(Arteriae pulmonales)
b) Ascending aorta
(Aorta ascendens)
c) Coronary artery
(Arteriae coro nariae)
d) Common carotid artery
(Arteria carotis communis)
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
e) Internal carotid
artery (Arteria carotis interna)
g) Cerebella arteries
(Arteriae cerebrates)
h) Brachiocephalic trunk
(Truncus brachiocephalicus)
i) Thoracic aorta
(Thoracica aorta)
k) Abdominal aorta
(Abdominalis aorta)
l) Common iliac arteries
(Arteriae ilica communis)
m) Descending aorta to
the bifurcation of aorta (Aorta descendens to the bifurcatio aortae)
n) Aortic arch (Arcus
aorta)
o) Cardiac veins (Venae
cordis)
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
q) Superior vena cava
(Venae cava superior)
r) Inferior vena cava
(Venae cava inferior)
6. Central nervous
system refers to the brain, meninges and spinal cord.
7. Continuous use of
a medical device means the uninterrupted use of the medical device, not
including any temporary interruption of its use during a procedure or any
temporary removal or the medical device for purposes such as cleaning or
disinfection; or the accumulated use of the medical device by replacing it
immediately with another medical device of the same type, as intended by its
product owner.
8. Transient use
means continuous use for less than 60 minutes.
9. Short-term use
means continuous use for between 60 minutes and 30 days.
10. Long-term use
means continuous use for more than 30 days.
11. Immediate danger
means a situation where the patient is at risk of either losing life or an
important physiological function if no preventative measure is taken.
12. Invasive medical
device means a medical device which, in whole or in part, penetrates inside the
body either through a body orifice or through the surface of the body,
including: implantable medical devices, surgically invasive medical devices,
medical devices through body orifices and medical devices through body surface.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
14. Surgically
invasive medical device means an invasive medical device that penetrates inside
the body through the surface of the body with the aid of surgical operation,
including medical devices that penetrate inside the body other than through a
natural body orifice.
15. In vitro
diagnostic (IVD) medical device for self-testing means any IVD medical device
intended by the product owner for use by lay persons.
16. Near-patient
testing means any testing performed outside a laboratory environment or at the
side of the patient.
17. Reagent means any
chemical, biological or immunological components solutions or preparations
intended by the product owner to be used as IVD medical devices.
18. Specimen
receptacle means an IVD medical device, whether vacuum-type or not,
specifically intended by their product owner for the primary containment of
specimens derived from the human body.
19. Transmissible
agent means an agent capable of being transmitted to a person, as a communicable,
infectious or contagious disease.
20. Transmission
means the conveyance of a disease to a person.
21. Life supporting
or life sustaining device means a medical device that is essential to, or that
yields information that is essential to, the restoration or continuation of a
bodily function important to the continuation of human life.
Part II
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
A. NON-INVASIVE OF
MEDICAL DEVICES
Rule 1. All non-invasive
medical devices which come into contact with injured skin:
1. are in Class A if
they are intended to be used as a mechanical barrier, for compression or for
absorption of exudates only i.e. healing they heal by primary intent.
2. are in Class B if
they are intended to be used principally with wounds which have breached the
dermis, including medical devices principally intended to manage the
microenvironment of a wound.
3. Unless they are
intended to be used principally with wounds which have breached the dermis and
can only heal by secondary intent, in which case they are in Class C.
Rule 2. Non-invasive
medical devices intended for channeling or storing
All non-invasive medical
devices intended for channeling or storing body liquids or tissues, liquids or
gases for the purpose of eventual infusion, administration or introduction into
the body are in Class A, unless:
1. they may be connected
to an active medical device in Class B or a higher class, in which case they
are Class B.
2. they are intended for
channeling blood, storing or channeling other body liquids, or storing organs,
parts of organs or body tissues, in which case they are Class B.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Rule 3. Non-invasive of
medical devices intended for modifying the biological or chemical composition
All non-invasive medical
devices intended for modifying the biological or chemical composition of blood,
other bodily liquids or other liquids intended for infusion into the body are
in Class C, unless the treatment consists of filtration, centrifuging or
exchanges of gas or heat, in which case they are in Class B.
Rule 4. Other
non-invasive of medical devices
All other non-invasive
medical devices are in Class A.
B. INVASIVE OF MEDICAL
DEVICES
Rule 5. Invasive of
medical devices with respect to body orifices other than those surgically
invasive
1. All invasive medical
devices with respect to body orifices (other than those which are surgically
invasive) and which are not intended for connection to an active medical
device, or are intended for connection to a Class A medical device only are in
Class A if they are intended for transient use. Unless they are intended by its
product owner for use on the external surface of any eyeball; or it is liable
to be absorbed by the mucous membrane, in which case they are in Class B.
2. All invasive medical
devices with respect to body orifices (other than those which are surgically
invasive) and which are not intended for connection to an active medical
device, or are intended for connection to a Class A medical device only are in
Class B if they are intended for short-term use. Unless they are intended for
use in the oral cavity as far as the pharynx, in an ear canal up to the ear
drum or in a nasal cavity, in which case they are in Class A.
3. All invasive medical
devices with respect to body orifices (other than those which are surgically
invasive) and which are not intended for connection to an active medical
device, or are intended for connection to a Class A medical device only are in
Class C if they are intended for long-term use. Unless they are intended for
use in the oral cavity as far as the pharynx, in an ear canal up to the ear
drum or in a nasal cavity and are not liable to be absorbed by the mucous
membrane, in which case they are in Class B.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Rule 6. Surgically
invasive medical devices intended for transient use
All surgically invasive
medical devices intended for transient use are in Class B, unless:
1. they are reusable
surgical instruments, in which case they are in Class A.
2. they are intended to
supply energy in the form of ionizing radiation, in which case they are in
Class C.
3. they are intended to
have a biological effect or be wholly or mainly absorbed, in which case they
are in Class C.
4. they are intended to
administer medicinal products by means of a delivery system, if this is done in
a manner that is potentially hazardous taking account of the mode of
application, in which they are in Class C.
5. they are they are
intended specifically for use in direct contact with the central nervous
system, in which case they are in Class D.
6. they are intended
specifically to diagnose, monitor or correct a defect of the heart or of the
central circulatory system through direct contact with these parts of the body,
in which case they are in Class D.
Rule 7. Surgically
invasive medical devices intended for short-term use
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
1. they are intended to
administer medicinal products, in which case they are in Class C.
2. they are intended to
undergo chemical change in the body (except the medical devices are placed in
the teeth), in which case they are in Class C.
3. they are intended to
supply energy in the form of ionizing radiation, in which case they are in
Class C.
4. they are intended to
have a biological effect or be wholly or mainly absorbed, in which case they
are in Class D.
5. they are they are
intended specifically for use in direct contact with the central nervous
system, in which case they are in Class D.
6. they are intended
specifically to diagnose, monitor or correct a defect of the heart or of the
central circulatory system through direct contact with these parts of the body,
in which case they are in Class D.
Rule 8. Surgically
invasive medical devices intended for long-term use and implantable medical
devices
All surgically invasive
medical devices intended for long-term use and implantable medical devices are
in class C, unless:
1. they are intended to
be placed into the teeth, in which case they are in Class B.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
3. they are intended to
be life supporting or life sustaining, in which case they are in Class D.
4. they are intended to
be active medical devices, in which case they are Class D.
5. they are intended to
have a biological effect or be wholly or mainly absorbed, in which case they
are in Class D.
6. they are intended to
administer medicinal products, in which case they are in Class D.
7. they are intended to
undergo chemical change in the body (except the medical devices are placed in
the teeth), in which case they are in Class D.
8. they are breast
implants, in which case they are in Class D.
C.
ACTIVE MEDICAL DEVICES
Rule 9. Active
therapeutic medical devices
All active therapeutic
medical devices intended to administer or exchange energy are in Class B,
unless:
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
2. they are intended to
control or monitor the performance of active therapeutic medical devices in
Class C, or intended directly to influence the performance of such medical
devices, in which case they are in Class C.
Rule 10. Active medical
devices intended for diagnosis
1. Medical devices used
to illuminate the patient’s body with light in the visible or near infra-red
spectrum are in Class A.
2. Active medical
devices intended for diagnosis are in Class B if:
a) they are intended to
supply energy which will be absorbed by the human body; except for those
specified in (a);
b) they are intended to
image in vivo distribution of radiopharmaceuticals;
c) they are intended to
allow direct diagnosis or monitoring of vital physiological processes.
3. Active medical
devices intended for diagnosis are in Class C if they are intended for one of
the following purposes:
a) monitoring of vital
physiological parameters, where the nature of variations is such that it could
result in immediate danger to the patient, for instance variations in cardiac
performance, respiration, activity of central nervous system; or
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
4. Active medical
devices intended to emit ionizing radiation and intended for diagnostic and/or
interventional radiology, including medical devices which control or monitor
such medical devices, or those which directly influence their performance, are
in Class C.
Rule 11. Active medical
devices intended to administer and/or remove medicinal products, body liquids
or other substances to or from the body
All active medical
devices intended to administer and/or remove medicinal products, body liquids
or other substances to or from the body are in Class B, unless this is done in
a manner that is potentially hazardous, taking account of the nature of the
substances involved, of the part of the body concerned and of the mode and
route of administration or removal, in which case they are in Class C.
Rule 12. Other active
medical devices
All other active medical
devices are in Class A.
D. OTHER RULES
Rule 13. Other active
medical devices
All medical devices
incorporating a substance which can be considered to be a medicinal product and
which is liable to act on the human body are in Class D.
Rule 14. Medical devices
of animal or microbial origin
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
a) animal cells, tissues
and/or derivatives thereof, rendered non-viable; or
b) cells, tissues and/or
derivatives of microbial or recombinant origin.
2. Medical devices that
are manufactured from or incorporate non-viable animal tissues or their
derivatives that come in contact with intact skin only are in Class A.
Rule 15. Medical devices
intended to be used for sterilizing or disinfecting
1. Medical devices
intended to be used for sterilizing medical devices are in class C.
2. Medical devices
intended to be used for disinfecting medical devices as the end point of
processing are in Class C.
3. Medical devices
intended to be used for disinfecting medical devices prior to end point
sterilization are in Class B.
4. Medical devices
intended to be used for disinfecting medical devices prior to higher level
disinfection are in Class B.
5. All medical devices
used for disinfecting, cleaning, rinsing or, when appropriate, hydrating
contact lenses are in Class C.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
1. All medical devices
used for contraception or prevention of transmission of sexually transmitted
diseases are in Class C.
2. Medical devices used
for contraception or prevention of transmission of sexually transmitted
diseases that are implantable or long-term invasive medical devices are in
class D.
Part III
RULES FOR CLASSIFICATION OF IVD MEDICAL DEVICES
Rule 1. IVD medical devices
intended for the following purposes are classified as Class D:
1. Medical devices
intended to be used to detect the presence of, or exposure to, a transmissible
agent in blood, blood components, blood derivatives, cells, tissues or organs
in order to assess their suitability for transfusion or transplantation.
2. Medical devices
intended to be used to detect the presence of, or exposure to, a transmissible
agent that causes a life-threatening, often incurable, disease with a high risk
of propagation
Rule 2
IVD medical devices
intended to be used for blood grouping, or tissue typing to ensure the
immunological compatibility of blood, blood components, cells, tissue or organs
that are intended for transfusion or transplantation are classified as Class C,
except for ABO system [A (AB01), B (AB02), AB (AB03)], rhesus system [RH 1 (D),
RH2 (C), RH3 (E), RH4 (c), RH5 (e)], Kell system [Kel1 (K)], Kidd system [JK1
(Jka), JK2 (Jkb)] and Duffy system [FY1 (Fya), FY2 (Fyb)] determination which
are classified as Class D.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
1. in detecting the
presence of, or exposure to, a sexually transmitted agent (e.g. Sexually
transmitted diseases, such as Chlamydia trachomatis, Neisseria gonorrhoeae).
2. in detecting the
presence in cerebrospinal fluid or blood of an infectious agent with a risk of
limited propagation (e.g. Neisseria meningitidis or Cryptococcus neoformans).
3. in detecting the
presence of an infectious agent where there is a significant risk that an
erroneous result would cause death or severe disability to the individual or
fetus being tested (e.g. diagnostic assay for CMV, Chlamydia pneumoniae,
Methycillin Resistant Staphylococcus aureus).
4. in pre-natal
screening of women in order to determine their immune status towards
transmissible agents (e.g. Immune status tests for Rubella or Toxoplasmosis).
5. in determining
infective disease status or immune status, and where there is a risk that an
erroneous result will lead to a patient management decision resulting in an
imminent life-threatening situation for the patient (e.g. Enteroviruses, CMV
and HSV in transplant patients).
6. in screening for
selection of patients for selective therapy and management, or for disease
staging, or in the diagnosis of cancer (e.g. personalized medicine).
Those IVD medical
devices where the therapy decision would usually be made only after further
investigation and those used for monitoring would fall into Class B under rule
6 - Part III.
7. in human genetic
testing (e.g. Huntington’s Disease, Cystic Fibrosis).
8. to monitor levels of
medicines, substances or biological components, when there is a risk that an
erroneous result will lead to a patient management decision resulting in an
immediate life-threatening situation for the patient (e.g. Cardiac markers,
cyclosporin, prothrombin time testing).
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
10. in screening for
congenital disorders in the fetus (e.g. Spina Bifida or Down Syndrome).
Rule 4
1. IVD medical devices
intended for self-testing are classified as Class C, except those medical
devices from which the result is not determining a medically critical status,
or is preliminary and requires follow-up with the appropriate laboratory test
in which case they are Class B.
2. IVD medical devices
intended for blood gases and blood glucose determinations for near-patient
testing would be Class C. Other IVD medical devices that are intended for near
patient should be classified in their own right using the classification rules.
Rule 5. The following
IVD medical devices are classified as Class A:
1. Other articles that participate
in or assist in the testing process, intended by the product owner to make them
suitable for IVD procedures related to a specific examination.
2. Instruments intended
by the product owner specifically to be used for IVD procedures.
3. Specimen receptacles.
Rule 6. IVD medical
devices not covered in Rules 1 through 5 are classified as Class B.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Section 2. GROUPING OF
MEDICAL DEVICES
Medical devices can
grouped as single medical devices or one of the following grouping categories:
a) Family;
b) In vitro diagnostic
(IVD) test kit;
c) System;
d) IVD cluster;
dd) Group;
1.
Single
medical devices
A single medical device
is a medical device from a product owner identified by a proprietary name or
brand name with a specific intended purpose and sold as a distinct packaged
entity and that cannot be assigned into a family, IVD test kit, system, IVD
cluster or group.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
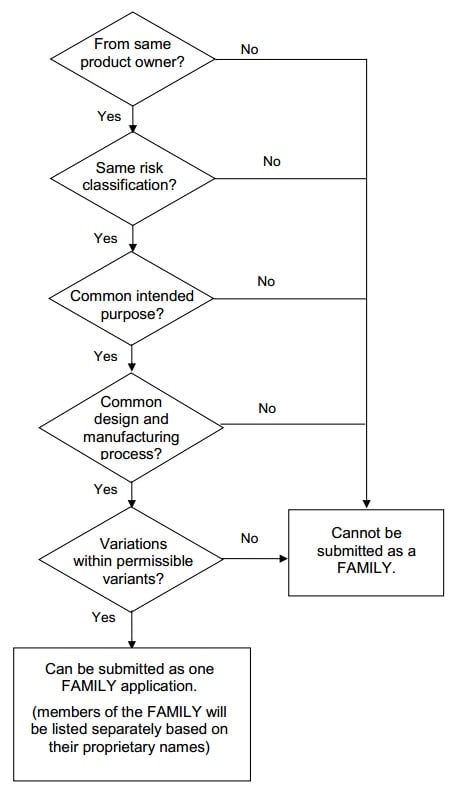
A medical device family
is a collection of medical devices and each medical device family member:
- is from the same
product owner;
- is of the same risk
classification;
- has a common intended
purpose;
- has a common design
and manufacturing process; and
- has variations that
are within the scope of the permissible variants.
Table 1. List of permissible variants in a family
Specific products
Permissible variants
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Retention (e.g. cement
or screw)
Active implantable
device
MR conditional and
non-MR conditional
Antibiotic test (IVD)
Concentration
Biopsy forceps
Formable or
non-formable
Blood bags
(i) Anticoagulants
with same composition but different concentrations
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Catheter
(i) Number of lumens
in catheter
(ii) Material of
catheter: PVC (polyvinylchloride), PU (polyurethane), nylon and silicone
(iii) Curvature
(iv) Coating material
for lubrication
Condoms
(i) Texture
(ii) Flavour
Contact lens
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(ii) UV protection
(iii) Tinting
(iv) Colour
(v) Wearing schedule
(i.e daily wear, extended wear)
(vi) Replacement
schedule (i.e daily, weekly, monthly)
Defibrillators
Automatic or
semi-automatic
Dental brackets
Material of bracket
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(i) Rotational speed
(ii) Material of
handpiece
Dermal fillers
Same composition but
different concentrations/densities
Diagnostic
radiographic systems
(i) Number of slices
(ii) Digital or Analog
(iii) Biplane and
Single Plane
(iv) Flat Panel or
Cassette
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Electrophysiological Catheter
(i) Electrode spacing
(ii) Number of
electrodes
Gloves
Powdered or
powder-free
Gamma Camera
Number of detectors
Guide wire
With or without inert
coating material
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(i) Cemented or
non-cemented fixation
(ii) Collar
Intra-ocular Lens
(i) Monofocal or
multifocal
(ii) Multi-piece or
single-piece
(iii) Aspheric or
spheric
Implantable pulse
generators
Number of chambers
(cardio)
IV cannula
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(ii) Presence of
safety wing
IVD rapid tests
Different assembly
format: tray, stick, pen, pipe, midstream, strip
IVD urinalysis strips
Different combination
of testing configurations
Polymer products
With or without plasticizers
(e.g. DEHP)
Stent
(i) Stent delivery
system, that is over-the-wire or through the scope
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Suture
(i) Number of strands
(ii) Pledgets
(iii) Loops
(iv) Dyes
Suture passer
Design of jaw, handle
or needle
Tracheal tube
(endotracheal tube,
tracheostomy tube)
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Wound dressings
Different formats
(e.g. solution, creams, gels loaded onto pads, etc)
X-ray detector
Scintillator material
Other permissible
variants in a family
Coating
material for lubrication only
Colour
Diameter,
length, width, gauge
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Dimensional
design differences due to paediatric versus adult use (The differences due to
the different patient population are permissible, e.g. volume and length)
Flexibility
Holding
force
Isotope
activity level
Memory
storage
Method
of Sterilization (to achieve same sterility outcome)
Printing
capability
Radiopacity
Shape,
size, volume
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Type of
device mounting (e.g. ceiling mount, wall mount or standing)
Sterility
status (sterile vs. non-sterile)
Decision flowchart for grouping of
medical devices as a family
3.
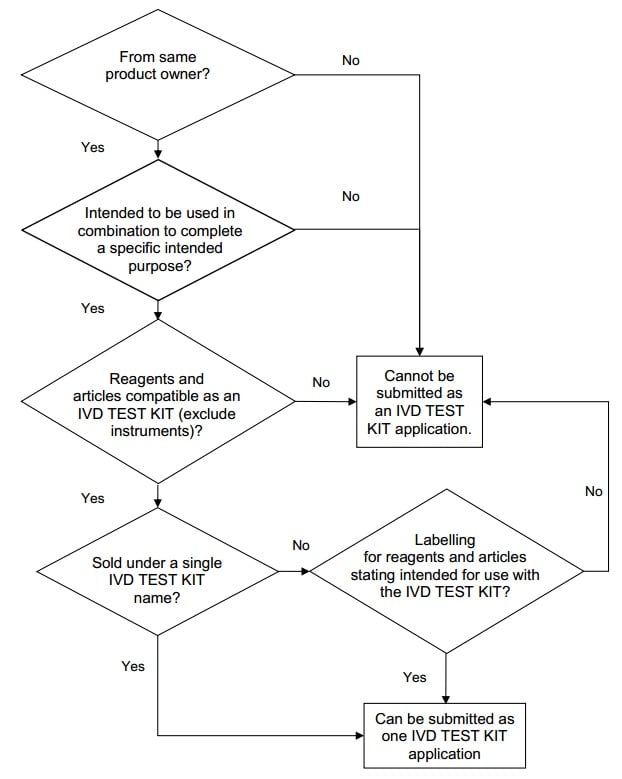
IVD
test kit
An IVD test kit is an in
vitro diagnostic (IVD) device that consists of reagents or articles that are:
- from the same product
owner;
- intended to be used in
combination to complete a specific intended purpose;
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
- compatible when used
as an IVD test kit.
An IVD test kit does not
include the instruments, such as analyzers, needed to perform the test. An IVD
medical device system may typically consist of test kits and instruments (e.g.
an analyzer designed to be used with that test kit).
Individual reagents or
articles in the IVD test kit can be supplied separately as replacement items
for the kit. If the reagents or articles in an IVD test kit are supplied for use
in more than one test kit, such reagents or articles shall be included in the
product registration application of each of the other test kits.
Reagents or articles
from another product owner may be grouped with the IVD test kit if the
applicant furnishes all information on these reagents or articles required for
registration, such as authorization from the other product owners for
registration and data to substantiate the performance of these reagents when
used in the test kit.
Example:
A Human Immunodeficiency
Virus (HIV) Enzyme Linked ImmunoSorbent Assay (ELISA) test kit may contain
controls, calibrators and washing buffers. All the reagents and articles are
used together to detect HIV and therefore can be considered as an IVD test kit.
These reagents and articles can be supplied separately as replacement items for
that particular test kit.
Decision flowchart for grouping of medical
devices as an IVD test kit
4.
System
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
- from the same product
owner;
- intended to be used in
combination to achieve a common intended purpose;
- compatible when used
as a system; and
- sold under a single
system name or the labeling, instructions for use, brochures or catalogues for
each constituent component indicates that the constituent component is intended
to be used together or for use with the system.
Devices that are part of
a system shall only be supplied specifically for use with that system. Any
device that is meant for supply for use with multiple systems should be
registered together with each of these other systems or they can be registered
separately.
A product owner of a
medical device system may incorporate medical devices and/or accessories from
other product owners (or manufacturers) as part of their system to achieve the
intended purpose of the device.
Example:
A patient monitoring
system from product owner A is intended to be used specifically with vital
signs sensors and probes from product owner B. These accessories are used in
combination to achieve a common intended purpose in accordance with product
owner A’s specifications, and can be grouped together with the patient
monitoring system in one application for registration.
Decision flowchart for grouping of medical
devices as a system
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Example on grouping of
systems as a family:
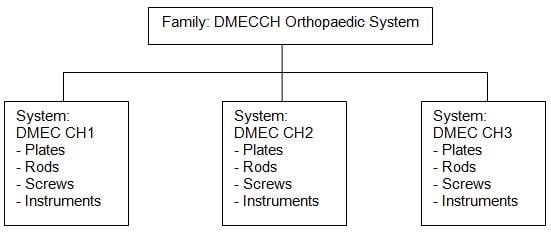
Note: the key
constituent-components, i.e. implantable rods, plates and screws, across the
systems are within the permissible variants. Differences in lengths of the
implantable screws are deemed permissible variants.
- A hip replacement
system comprising of femoral and acetabular components can be grouped as a
system. The components must be used in combination to achieve a common intended
purpose of total hip replacement. The size of the components may vary.
- An electrosurgical
unit and its accessories that consist of forceps, electrodes, electrode
holders, leads, plug adaptor, when used together for a common intended purpose,
can be grouped as a system.
- A catheter placement set/kit
comprising of scalpels, syringes, needles, surgical gloves, gauze, drapes and
flushing solution that is validated for compatibility and assembled by a single
product owner under a single system name for use in combination during a
surgical catheter placement procedure can be grouped as a system.
- Automated blood
pressure monitors with optional features such as memory storage and print
capability for various models can be considered as part of a family of systems.
5.
IVD
cluster
An IVD cluster comprises
of a number of in vitro diagnostic reagents or articles that are:
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
- is of the same risk
classification (either Class A only or Class B only);
- of the same IVD
cluster category and a common test methodology as listed in Table 2; and
The IVD cluster may
include analyzers that are designed for use with the reagents in the IVD
cluster.
Table 2. List of common test methodologies
and IVD cluster categories
No.
Methodology
Cluster category
(closed list)
Examples of analytes
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Clinical Chemistry
Enzymes
(i) Acid
Phosphatase
(ii)
Alpha-Amylase
(iii) Creatine
Kinase
(iv)
Gamma-Glutamyl Transferase
(v) Lactate
Dehydrogenase
(vi) Lipase
2
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(i) Albumin
(ii) Bilirubin
(iii)
Urea/Blood Urea Nitrogen
(iv)
Cholesterol
(v) Creatinine
(vi) Glucose
3
Electrolytes reagents
(i) Ammonia
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(iii) Calcium
(iv) Chloride
(v) Magnesium
(vi) Phosphate
Inorganic/Phosphorus
4
Electrolytes
electrodes
(i) Ammonia
electrodes
(ii) Carbon
Dioxide (Bicarbonate) electrodes
(iii) Calcium
electrodes
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(v) Magnesium
electrodes
(vi) Potassium
electrodes
5
Substrate
electrodes/biosensors
(i) Creatinine
electrodes
(ii) Glucose
electrodes
(iii) Glycated
Hemoglobin electrodes
(iv) Lactate
electrodes
(v) Urea electrodes
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
6
Immunochemistry
Immunoglobulins
(without IgE)
(i)
Immunoglobulin A
(ii)
Immunoglobulin D
(iii)
Immunoglobulin G
(iv)
Immunoglobulin M
(v)
Immunofixation kits
7
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(i) Complement
component C1q
(ii) Complement
component C1 inactivator
(iii)
Complement component C3/C3c
(iv)
Complement component for Bb
(v) Complement
component C4
(vi)
Complement component C5a
8
Transport proteins
(i) Albumin
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(iii)
Haptoglobin
(iv) Hemopixin
(v) Lactoferrin
(vi)
Pre-albumin/Transthyretin
9
Lipoproteins
(i)
Apolipoprotein A I
(ii)
Apolipoprotein A II
(iii)
Apolipoprotein B
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(v)
Lipoprotein (a)
10
Other specific
proteins
(i) a1-Acid
Glycoprotein
(ii)
a1-Antitrypsin
(iii)
a1-Microglobulin
(iv)
Fibronectin
(v) Immuno
Reactive Trypsin
11
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(i)
Immunoglobulin E - Total
(ii)
Immunoglobulin E - Screen
(iii)
Immunoglobulin E – Specific, monotest/monoresult
(iv) Allergen
specific IgA
(v) Allergen
specific IgG
12
Cancer markers
(i) GI-marker
CA242
(ii) p53
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Thyroid function
markers
(i) Free
triiodothyronine
(ii) Free
thyroxine
(iii) Thyroid
stimulating hormone
(iv) T -
Uptake
(v)
Thyroglobulin
(vi) Neonatal
Thyroxine
14
Fertility/pregnancy
hormones/proteins
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(ii) Estradiol
(iii)
Prolactin
(iv) Human
placental lactogen
(v) Estriol
15
Diabetes assays
(hormones)
(i) C-Peptide
(ii) Melatonin
(iii) Insulin
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(v) Islet Cell
Ab
(vi)
Proinsulin
16
Renal metabolism assays
(i)
Aldosterone
(ii)
Angiotensin I / II
(iii)
Angiotensin-converting enzyme
(iv) Cortisol
(v) Renine
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Bone and mineral
metabolism assays
(i) Bone
alkaline phosphatase
(ii)
Calcitonin
(iii)
Cross-linked C-Telopeptides
(iv)
Cross-linkded N-Telopeptides
(v) Cyclic
Adenosin Monophosphate
(vi)
Hydroxyproline
18
Endocrine Hormones and
Peptides
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(ii) Human
Growth Hormone
(iii)
Insulin-like growth factor I
(iv)
Insulin-like Growth Factor Binding Protein 1
(v)
Vasointestinal Peptide
(vi)
Vasopressin
19
Neuroendocrine
function assays
(i) Bombesin
(ii)
17-Hydroxy-Ketosterone
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(iv)
Proinsulin
(v)
Somatostatin
(vi) Substance
P
20
Other individual and
specified hormones
(i) Gastrin
(ii)
Gonadotropin-releasing hormone
(iii)
Melatonin
(iv)
Pepsinogen
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(vi) Dopamine
21
Anaemia
(i)
Erythropoietin
(ii) Ferritin
(iii) Folate
(iv) Iron
(v) Iron
binding capacity
(vi) Soluble
transferrin receptor
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Vitamins
(i) Vitamin B1
(ii) Vitamin
B2
(iii) Vitamin
B6
(iv) Vitamin
B12
(v) Vitamin D
(Cholecalciferol)
(vi) Intrinsic
factor (Blocking antibody)
23
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(i) Caffeine
(ii)
Benzodiazepines
(iii)
Penicillins
(iv)
Tetracyclines
24
Toxicology
(i)
Amphetamines
(ii) Cocaine
(iii)
Morphines
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(v)
Acetaminophen
(vi)
Catecholamines
(vii) Ethanol
(viii)
Salicylate
25
Auto-immune diseases
(i)
Anti-nuclear antibodies (ANAs)
(ii)
Anti-topoisomerase
(iii)
Organ-specific autoantibodies
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(v) TSH
Receptor antibodies
(vi)
Anti-Cardiolipin antibodies
26
Rheumatoid-inflammatory
diseases markers
(i)
Anti-Streptococcal Hyaluronidase
(ii)
Anti-Streptokinase
(iii)
Anti-Streptolysin O
(iv)
C-Reactive Protein
(v)
Anti-Staphylolysin
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
27
Liver function
(i) MEGX
(ii)
Carbohydrate Deficient Transferrin
28
Cardiac markers
(i) Homocysteine
(ii) pT2
(iii)
Galectin-3
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
29
Bacterial infection -
Immunology
(i) Bacillus
subtilis
(ii)
Pseudomonas Aeruginosa
(iii)
Helicobacter Pylori
(iv)
Lactobacillus casei
30
Viral infection -
Immunology
(i) Norovirus
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(iii)
Hantavirus
31
Parasitic infection –
Immunology
(i) Leishmania
32
Fungal infection -
Immunology
(i) Candida
albicans
(ii)
Aspergillus
33
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(Blood tests for
transfusions excluded)
Hemoglobin testing
(i) Hemoglobin
determinations
(ii)
Fractional oxyhemoglobin (FO2Hb)
(iii)Fractional
carboxyhemoglobin (FCOHb)
(iv)
Fractional methemoglobin (FMetHb)
(v) Fractional
deoxyhemoglobin (FHHb)
34
General coagulation
tests
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(ii) Thrombin
time
(iii)
Activated clotting time
(iv) Activated
partial thromboplastin
35
Haemostasis
(Coagulation)
(i) Fibrinogen
(ii) Protein C
and Protein S reagents
(iii) C1
inhibitors
(iv)
Alpha-Antiplasmin
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(vi) Factor
XIII
(vi) Platelet
Factor 4
(vii)
Plasminogen
36
Other hematology
tests
(i) Complete
blood count
(ii)
Hematocrit
(ii)
Erythrocyte sedimentation rate
37
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(i)
Interferons
(ii) Soluble
antigens/Receptors
(iii) Tumor
necrosis factors
(iv) Colony
stimulating factors
(vi) Tumor Necrosis
Factors receptors
38
Histology/Cytology
reagent
(i)
Cytochemical staining
(ii)
Embedding, fixing, mounting media
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(iv)
Immunohistology kits
39
Culture media
(i) Dehydrated
culture media (DCM)
(ii) Additives
for DCM
(iii) Prepared
media (tubes, bottles, plates)
(iv) Cells,
media, serum for viral culture
40
Testing for
the susceptibility of the bacteria to certain antibiotics
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(ii)
Tobramycin susceptibility test for Pseudomonas aeruginosa
(iii) Fungal
susceptibility testing
41
Biochemical
culture Identification (ID)
(i) Gram
Negative Manual ID
(ii) Gram
Positive Manual ID
(iii) Other ID
Kits Manual - Anaerobes, Fastidious
42
Immunological
culture Identification (ID)
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(ii)
Serotyping (E.coli, Salmonella, Shigella, etc.)
43
Nucleic Acid
(NA) based culture identification (ID)
(i)
Streptococci
(ii) Shigella
44
Serological
identification (ID)
(i) For
Parasitology and Mycology
45
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(Detection by
NA Reagents)
(i)
Streptococci
(ii) Shigella
46
Viral
Infections (Detection by NA Reagents)
(i)
Para-influenza NA Reagents
47
Fungal
infections
(i) Fungi NA
Reagents
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
(iii)
Aspergillus
Decision flowchart for grouping of
medical devices as an IVD cluster
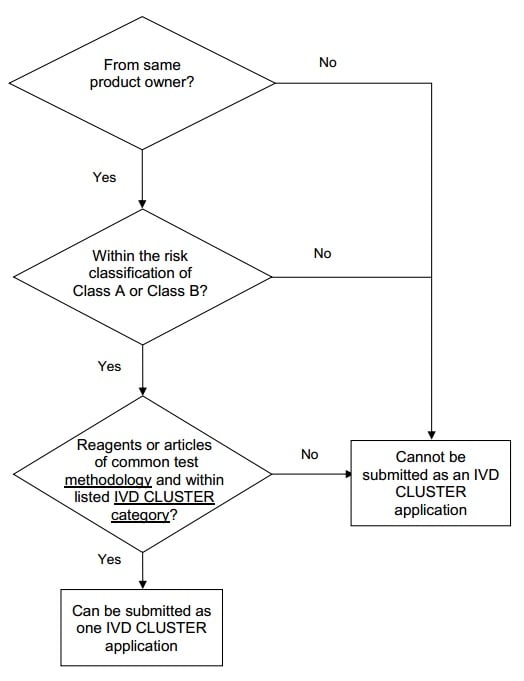
If a reagent or article
is intended for multiple usage categories, it can be grouped into more than one
IVD cluster.
Example of a Class B IVD
cluster grouping with 4 products within the Cluster category - Enzymes
Example: Product owner
is “DMEC”
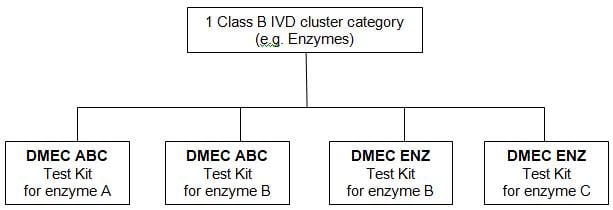
Based on the example,
the 04 IVD products qualify to be submitted as one IVD cluster category
(Enzymes) and would be listed as follows:
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
2. DMEC ABC Test Kit for
Enzyme B**
3. DMEC ENZ Test Kit for
Enzyme B***
4. DMEC ENZ Test Kit for
Enzyme C****
* DMEC ABC Test Kit for
enzyme A is under one listing in which DMEC is the product owner and ABC is the
proprietary name.
I* DMEC ABC Test Kit for
enzyme B is under one listing in which DMEC is the product owner and ABC is the
proprietary name.
*** DMEC ENZ Test Kit
for enzyme B is under one listing in which DMEC is the product owner and ENZ is
the proprietary name.
**** DMEC ENZ Test Kit
for enzyme C is under one listing in which DMEC is the product owner and ENZ is
the proprietary name.
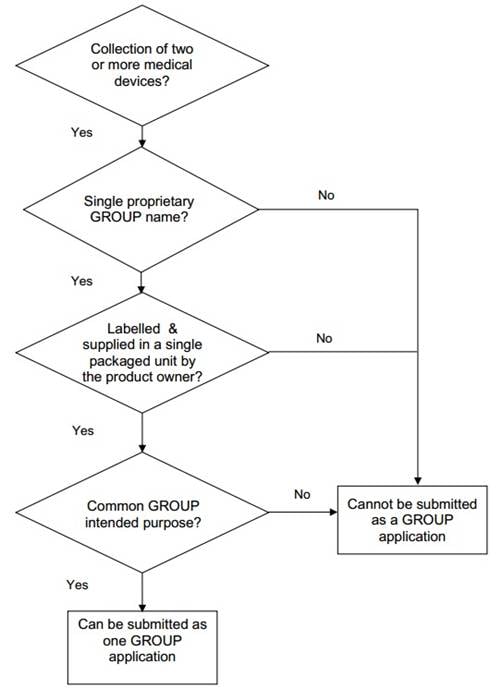
6.
Other
medical device groups
A group of medical
devices is a collection of two or more medical devices other than IVD medical
devices that is labeled and supplied in a single packaged unit by a product
owner. The medical device group comprises of the following:
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
- labeled and supplied
in a single packaged unit by the product owner; and
- a common intended
purpose.
This list of medical
devices in a group may differ in the number (quantity) and combination of
products that comprise the group, while maintaining the same proprietary name
and intended purpose of the group.
A product owner of the group
assumes responsibility for the group and its intended purpose. The product
owner of a medical device group may incorporate medical devices obtained from
other manufacturers/product owners as part of their group to achieve the common
intended purpose. In manufacturing and assembling this group of medical devices,
the evidence to substantiate the safety, quality and efficacy of the collection
of devices shall be provided in the submission. Relevant information for
submission may include sterility, shelf life, evidence on use and compatibility
as a group, quality management systems, etc. Labeling, particularly the
instructions for use (IFU), where applicable, shall clearly describe the common
intended purpose of the group.
Medical devices that are
registered within a group must have a single medical device registration before
they are sold separately as individual medical devices for their specific
individual intended purpose or as replacements.
If a medical device in a
group is supplied for use in another group, such a medical device shall be
included in the registration application of that other group.
The group name indicated
for the medical device must appear in the product label affixed on the external
package of the group. The content list of devices in the group must appear on
the external package of the group or supplied with the group.
Example:
- A first aid group
consisting of medical devices such as bandages, gauzes, drapes and
thermometers, when assembled together as one package for a common medical
purpose by a product owner, can be registered as a group.
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
- A promotional pack or
convenience pack, without a group name and without a common intended medical
purpose, consisting of different number of medical devices, for example
multi-purpose solution, saline solution, and contact lens case, will not
qualify as a group registration. Individual medical devices shall require
registration as single medical devices.
Decision flowchart for grouping of medical devices
as a group
APPENDIX II
(Promulgated together with Circular No.
05/2022/TT-BYT dated August 01, 2022 of the Minister of Health)
NAME OF FACILITY
-------
SOCIALIST REPUBLIC OF VIETNAM
Independence - Freedom – Happiness
---------------
No. …..…
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
MEDICAL DEVICE CLASSIFICATION SHEET
Pursuant to the
Government’s Decree No. 98/2021/ND-CP dated November 08, 2021 on management of medical
devices;
Pursuant to Circular No.
... /2022/TT-BYT dated ... elaborating the Government’s Decree No. 98/2021/ND-CP
dated November 08, 2021 on management of medical devices.
Below is our
classification of medical devices:
No.
Name of medical device
Category/code
Manufacture, country of origin
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Owner's intended uses
Basis for risk classification
Risk classification
...
...
...
Hãy đăng nhập hoặc đăng ký Thành viên
Pro tại đây để xem toàn bộ văn bản tiếng Anh.
Legal representative of the
facility
(Signature, full
name, position,
Certified by seal or digital signature)
____________________________
1 Location
