Sửa thông tin số đăng ký 05 loại thuốc được cấp giấy đăng ký lưu hành tại Việt Nam?
Sửa đổi thông tin số đăng ký 05 loại thuốc được cấp giấy đăng ký lưu hành tại Việt Nam?
Tại Phụ lục Danh mục các thông tin sửa đổi của các thuốc được cấp giấy đăng ký lưu hành tại việt nam ban hành kèm theo các quyết định cấp giấy đăng ký lưu hành của Cục Quản lý dược ban hành kèm theo Quyết định 267/QĐ-QLD năm 2023 có quy định về thông tin sửa đổi 05 loại thuốc được cấp giấy đăng ký lưu hành tại Việt Nam như sau:
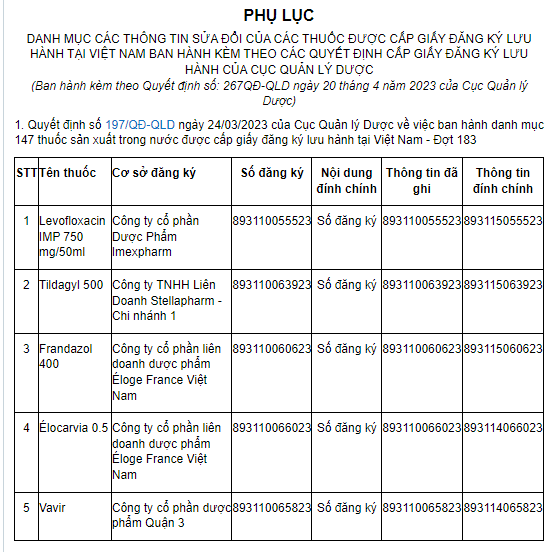
Như vậy, 05 loại thuốc sửa đổi thông tin số đăng ký bao gồm: Levofloxacin IMP 750 mg/50ml; Tildagyl 500; Frandazol 400; Élocarvia 0.5; Vavir.

Sửa thông tin số đăng ký 05 loại thuốc được cấp giấy đăng ký lưu hành tại Việt Nam? (Hình từ Internet)
Thời hạn hiệu lực của giấy đăng ký lưu hành thuốc là bao nhiêu năm?
Tại khoản 1, khoản 2 Điều 8 Thông tư 08/2022/TT-BYT có quy định về thời hạn hiệu lực của giấy đăng ký lưu hành thuốc như sau:
Hiệu lực, ký hiệu của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc và thời hạn nộp hồ sơ đăng ký gia hạn; số lượng giấy đăng ký lưu hành cho các thuốc có cùng dược chất hoặc thành phần dược liệu, dạng bào chế, đường dùng, hàm lượng hoặc nồng độ trong một đơn vị phân liều
1. Thời hạn hiệu lực của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc là 05 (năm) năm kể từ ngày cấp hoặc gia hạn, trừ trường hợp quy định tại khoản 2 Điều này.
2. Thời hạn hiệu lực của giấy đăng ký lưu hành là 03 (ba) năm kể từ ngày cấp đối với các thuốc sau:
a) Thuốc mới, vắc xin lần đầu cấp giấy đăng ký lưu hành, sinh phẩm tham chiếu, sinh phẩm tương tự lần đầu cấp giấy đăng ký lưu hành tại Việt Nam;
b) Thuốc cùng dược chất, nồng độ, hàm lượng, dạng bào chế với thuốc mới mà thuốc mới đó chưa được cấp giấy đăng ký lưu hành với thời hạn 05 (năm) năm;
c) Các trường hợp tiếp tục theo dõi an toàn, hiệu quả theo ý kiến tư vấn của Hội đồng;
d) Thuốc thuộc trường hợp quy định tại điểm a, b và c khoản này nhưng tại thời điểm nộp hồ sơ gia hạn giấy đăng ký lưu hành mà chưa có báo cáo an toàn, hiệu quả vì lý do chưa lưu hành hoặc có báo cáo an toàn, hiệu quả nhưng số lượng thuốc sử dụng, số lượng bệnh nhân, thời gian sử dụng còn hạn chế theo ý kiến của Hội đồng hoặc có khuyến nghị của cơ sở khám chữa bệnh về việc cần tiếp tục theo dõi an toàn, hiệu quả.
...
Theo đó, giấy đăng ký lưu hành thuốc có thời hạn hiệu lực là 03 (ba) năm kể từ ngày cấp đối với các thuốc sau:
- Thuốc mới, vắc xin lần đầu cấp giấy đăng ký lưu hành, sinh phẩm tham chiếu, sinh phẩm tương tự lần đầu cấp giấy đăng ký lưu hành tại Việt Nam;
- Thuốc cùng dược chất, nồng độ, hàm lượng, dạng bào chế với thuốc mới mà thuốc mới đó chưa được cấp giấy đăng ký lưu hành với thời hạn 05 (năm) năm;
- Các trường hợp tiếp tục theo dõi an toàn, hiệu quả theo ý kiến tư vấn của Hội đồng;
- Thuốc thuộc 03 trường hợp trên nhưng tại thời điểm nộp hồ sơ gia hạn giấy đăng ký lưu hành mà chưa có báo cáo an toàn, hiệu quả vì lý do chưa lưu hành hoặc có báo cáo an toàn, hiệu quả nhưng số lượng thuốc sử dụng, số lượng bệnh nhân, thời gian sử dụng còn hạn chế theo ý kiến của Hội đồng hoặc có khuyến nghị của cơ sở khám chữa bệnh về việc cần tiếp tục theo dõi an toàn, hiệu quả.
Các trường hợp còn lại, thời hạn hiệu lực của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc là 05 (năm) năm kể từ ngày cấp hoặc gia hạn.
Nộp hồ sơ cấp giấy đăng ký lưu hành thuốc tại cơ quan nào?
Tại Điều 35 Thông tư 08/2022/TT-BYT có quy định về cơ quan tiếp nhận hồ sơ cấp giấy đăng ký lưu hành thuốc như sau:
Quy định chung về trình tự cấp, gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc
1. Hồ sơ được nộp trực tuyến, nộp trực tiếp hoặc gửi qua đường bưu điện đến Cục Quản lý Dược.
2. Sau khi nhận được đầy đủ hồ sơ, Cục Quản lý Dược trả cho cơ sở đăng ký Phiếu tiếp nhận hồ sơ theo Mẫu 9/TT ban hành kèm theo Thông tư này.
Cục Quản lý Dược tiếp nhận hồ sơ mà không bắt buộc phải nộp CPP đối với trường hợp quy định tại điểm e khoản 4 Điều 22 Thông tư này và tài liệu quy định tại điểm b khoản 1 Điều 24 Thông tư này tại thời điểm nộp hồ sơ.
3. Đối với hồ sơ nhập khẩu thuốc chưa có giấy đăng ký lưu hành, việc tiếp nhận hồ sơ thực hiện theo quy định tại điểm b khoản 1 Điều 77 Nghị định số 54/2017/NĐ-CP.
4. Tổ chức thẩm định hồ sơ đề nghị cấp, gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc và hồ sơ nhập khẩu thuốc chưa có giấy đăng ký lưu hành:
a) Cục Quản lý Dược chuyển hồ sơ cho các chuyên gia hoặc các đơn vị được Bộ Y tế giao nhiệm vụ để tổ chức thẩm định trên cơ sở danh sách chuyên gia do Cục Quản lý Dược hoặc các đơn vị thẩm định thành lập, phê duyệt;
b) Trên cơ sở tổng hợp ý kiến thẩm định của các chuyên gia hoặc các đơn vị thẩm định và xem xét các thông tin liên quan, Cục Quản lý Dược chịu trách nhiệm đề xuất việc cấp, gia hạn, thay đổi, bổ sung hoặc chưa cấp, gia hạn, thay đổi, bổ sung hoặc không cấp, gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc; cấp, chưa cấp hoặc không cấp giấy phép nhập khẩu thuốc chưa có giấy đăng ký lưu hành. Ý kiến đề xuất của Cục Quản lý Dược được thể hiện trên biên bản thẩm định;
c) Cục Quản lý Dược trình Hội đồng xem xét, tư vấn về các ý kiến đề xuất của Cục Quản lý Dược quy định tại điểm b khoản này đối với các trường hợp sau:
- Cấp, không cấp; gia hạn, không gia hạn; phê duyệt, không phê duyệt thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc trừ trường hợp quy định tại khoản 5 Điều này;
- Công bố, không công bố biệt dược gốc, sinh phẩm tham chiếu trừ trường hợp cơ sở đăng ký thuốc không phải nộp hồ sơ đề nghị phân loại biệt dược gốc, sinh phẩm tham chiếu quy định Điều 9 Thông tư này;
- Cấp, không cấp giấy phép nhập khẩu thuốc chưa có giấy đăng ký lưu hành;
- Các trường hợp khác do Cục Quản lý Dược đề xuất để đáp ứng nhu cầu cấp thiết trong phòng bệnh, chữa bệnh.
5. Đối với các hồ sơ đề nghị cấp, gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, cơ sở chỉ được phép sửa đổi, bổ sung không quá 03 lần. Nếu quá số lần sửa đổi, bổ sung nêu trên mà hồ sơ sửa đổi, bổ sung chưa đạt, Cục Quản lý Dược có công văn thông báo không đồng ý cấp, gia hạn giấy đăng ký lưu hành, không đồng ý phê duyệt hồ sơ thay đổi, bổ sung. Hồ sơ đã nộp không còn giá trị.
Theo đó, hồ sơ được nộp trực tuyến, nộp trực tiếp hoặc gửi qua đường bưu điện đến Cục Quản lý Dược.
Trân trọng!








Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.
- Mẫu Báo cáo thành tích cá nhân của Phó hiệu trưởng mới nhất năm 2024?
- Hướng dẫn xóa thí sinh khỏi danh sách Vòng 6 Trạng Nguyên Tiếng Việt tại quantri.trangnguyen.edu.vn?
- Tháng 10 âm lịch 2024 kết thúc vào ngày nào? Tháng 10 âm lịch 2024 là tháng con gì? Tháng 10 âm lịch năm 2024 có sự kiện gì?
- Cách viết trách nhiệm của cá nhân đối với những hạn chế, khuyết điểm của tập thể trong bản kiểm điểm đảng viên cuối năm 2024?
- Giám đốc BHXH cấp tỉnh có quyền xử phạt hành vi cho mượn thẻ bảo hiểm y tế không?








