Danh sách các sản phẩm si rô ho bị cấm sử dụng từ ngày 21/04/2023?
- Danh sách các sản phẩm si rô ho bị cấm sử dụng từ ngày 21/04/2023?
- Tại sao các sản phẩm si rô ho tại Công văn 2349/BYT-QLD năm 2023 lại bị cấm sử dụng?
- Nhiệm vụ của các cơ sở khám, chữa bệnh trong việc thực hiện quy định cấm sử dụng đối với các sản phẩm si rô ho tại Công văn 2349/BYT-QLD năm 2023 là gì?
Danh sách các sản phẩm si rô ho bị cấm sử dụng từ ngày 21/04/2023?
Ngày 21/04/2023, Bộ Y tế ban hành Công văn 2349/BYT-QLD năm 2023 về cảnh báo đối với sản phẩm si rô ho bị cấm sử dụng.
Theo Danh sách các sản phẩm trong diện cảnh báo của Interpol ban hành kèm theo Công văn 2349/BYT-QLD năm 2023, quy định về các sản phẩm si rô ho bị cấm sử dụng từ ngày 21/04/2023 như sau:
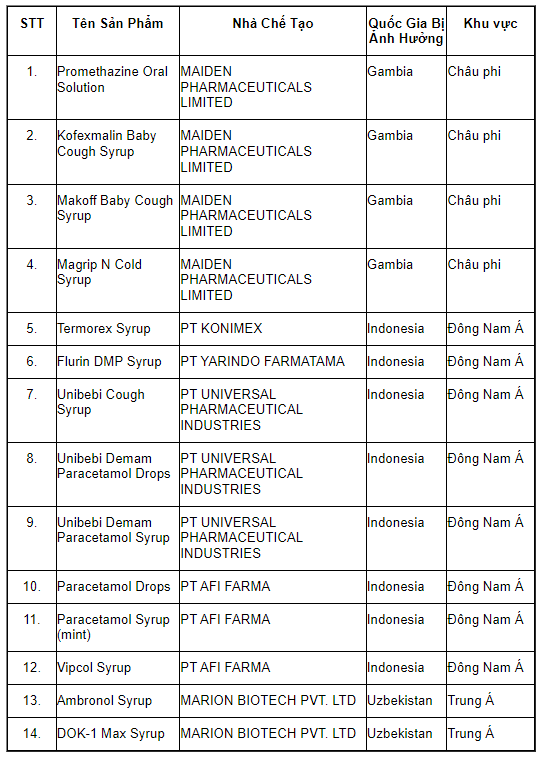
Theo đó, các sản phẩm si rô ho bị cấm sử dụng từ ngày 21/04/2023 gồm 14 sản phẩm như sau:
- Promethazine Oral Solution
- Kofexmalin Baby Cough Syrup
- Makoff Baby Cough Syrup
- Magrip N Cold Syrup
- Termorex Syrup
- Flurin DMP Syrup
- Unibebi Cough Syrup
- Unibebi Demam Paracetamol Drops
- Unibebi Demam Paracetamol Syrup
- Paracetamol Drops
- Paracetamol Syrup (mint)
- Vipcol Syrup
- Ambronol Syrup
- DOK-1 Max Syrup

Danh sách các sản phẩm si rô ho bị cấm sử dụng từ ngày 21/04/2023? (Hình từ Internet)
Tại sao các sản phẩm si rô ho tại Công văn 2349/BYT-QLD năm 2023 lại bị cấm sử dụng?
Nội dung Công văn 2349/BYT-QLD năm 2023 thể hiện các lý do các sản phẩm si rô ho tại Công văn bị cấm sử dụng như sau:
Bộ Y tế nhận được Công điện của Tổ chức Cảnh sát hình sự quốc tế (Interpol) cảnh báo các cơ quan chức năng thành viên của Interpol về việc hàng trăm trẻ em đã tử vong hoặc bị tổn thương thận cấp tính sau khi sử dụng 14 sản phẩm si rô ho bị cấm ở một số quốc gia. Theo thông tin từ Interpol, các sản phẩm này được sản xuất tại Ấn Độ và Indonesia có chứa Diethylene có thể dẫn đến tổn thương sức khỏe nghiêm trọng hoặc tử vong cho người sử dụng (Xin gửi kèm theo danh sách và hình ảnh 14 sản phẩm si rô nêu trên).
Theo rà soát của Bộ Y tế (Cục Quản lý Dược), 14 sản phẩm này chưa được cấp giấy đăng ký lưu hành thuốc tại Việt Nam và cũng chưa được cấp giấy phép nhập khẩu vào Việt Nam.
Để bảo đảm an toàn cho người sử dụng, Bộ Y tế đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, các cơ sở khám, chữa bệnh trực thuộc Bộ Y tế khẩn trương triển khai các hoạt động như sau:
...
Theo đó, nguyên nhân các sản phẩm si rô ho tại Công văn 2349/BYT-QLD năm 2023 bị cấm sử dụng tại Việt Nam vì:
Các sản phẩm si rô ho tại Công văn 2349/BYT-QLD năm 2023 là các sản phẩm được sản xuất tại Ấn Độ và Indonesia có chứa Diethylene có thể dẫn đến tổn thương sức khỏe nghiêm trọng hoặc tử vong cho người sử dụng.
Thực tế cho thấy hàng trăm trẻ em đã tử vong hoặc bị tổn thương thận cấp tính sau khi sử dụng 14 sản phẩm si rô ho này,
14 sản phẩm si rô ho tại Công văn 2349/BYT-QLD năm 2023 chưa được cấp giấy đăng ký lưu hành thuốc tại Việt Nam và chưa được cấp giấy phép nhập khẩu vào Việt Nam.
Nhiệm vụ của các cơ sở khám, chữa bệnh trong việc thực hiện quy định cấm sử dụng đối với các sản phẩm si rô ho tại Công văn 2349/BYT-QLD năm 2023 là gì?
Nội dung Công văn 2349/BYT-QLD năm 2023 quy định nhiệm vụ của các cơ sở khám, chữa bệnh trong việc thực hiện quy định cấm sử dụng đối với các sản phẩm si rô ho tại Công văn 2349/BYT-QLD năm 2023 như sau:
Để bảo đảm an toàn cho người sử dụng, Bộ Y tế đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, các cơ sở khám, chữa bệnh trực thuộc Bộ Y tế khẩn trương triển khai các hoạt động như sau:
1. Phổ biến, thông báo cho các cơ sở y tế, cơ sở dược trên địa bàn, các khoa, phòng tại đơn vị biết về các thông tin cảnh báo đối với 14 sản phẩm si rô ho nêu trên để khuyến cáo về tác hại nghiêm trọng nếu sử dụng sản phẩm và nghiêm cấm sử dụng. Tăng cường tuyên truyền trên địa bàn và tại đơn vị về việc không sử dụng các thuốc không được cấp phép lưu hành, không rõ nguồn gốc, xuất xứ.
2. Sở Y tế các tỉnh, thành phố trực thuộc Trung ương tiến hành thanh tra, kiểm tra tại các cơ sở kinh doanh dược việc lưu hành các sản phẩm này nói riêng và các thuốc không có nguồn gốc, xuất xứ, chưa được cấp phép lưu hành nói chung trên thị trường. Trường hợp phát hiện các sản phẩm này có lưu hành, tiến hành thu hồi, tiêu hủy và xử lý vi phạm đối với các cơ sở kinh doanh dược theo quy định, tránh gây hại cho người sử dụng. Kết quả kiểm tra, xử lý các trường hợp vi phạm (nếu có), đề nghị Sở Y tế báo cáo về Bộ Y tế (Cục Quản lý Dược).
Theo đó, các cơ sở khám, chữa bệnh có nhiệm vụ:
- Phổ biến, thông báo cho các cơ sở y tế, cơ sở dược trên địa bàn, các khoa, phòng tại đơn vị biết về các thông tin cảnh báo đối với 14 sản phẩm si rô ho nêu trên để khuyến cáo về tác hại nghiêm trọng nếu sử dụng sản phẩm và nghiêm cấm sử dụng.
- Tăng cường tuyên truyền trên địa bàn và tại đơn vị về việc không sử dụng các thuốc không được cấp phép lưu hành, không rõ nguồn gốc, xuất xứ.
Trân trọng!










Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.
- Kể về một việc tốt mà em đã làm để bảo vệ môi trường lớp 3 chọn lọc 2025?
- Tham khảo bài mẫu viết thư UPU lần thứ 54: Làm thế nào để bảo vệ đại dương?
- 28 tháng 2 âm lịch là ngày mấy dương 2025? Người lao động nghỉ giữa giờ bao nhiêu phút khi làm việc 8 giờ ngày 28 tháng 2 2025 âm lịch?
- Tháng 2 2025 có ngày 29 dương lịch không? 29 tháng 2 là ngày gì mà 4 năm mới xuất hiện một lần?
- khaothi vnu edu vn đăng nhập Link đăng ký thi đánh giá năng lực 2025 Hà Nội HSA?








