Mẫu tóm tắt sản phẩm đề nghị cấp giấy đăng ký lưu hành đối với thuốc cổ truyền (không bao gồm vị thuốc cổ truyền) được quy định như thế nào?
- Mẫu tóm tắt sản phẩm đề nghị cấp giấy đăng ký lưu hành đối với thuốc cổ truyền (không bao gồm vị thuốc cổ truyền) được quy định như thế nào?
- Quy định về sáng chế và bảo mật liên quan đến thuốc cổ truyền đăng ký?
- Xác định thuốc cổ truyền được miễn thử lâm sàng tại Việt Nam phải dự trên những tiêu chí nào?
Mẫu tóm tắt sản phẩm đề nghị cấp giấy đăng ký lưu hành đối với thuốc cổ truyền (không bao gồm vị thuốc cổ truyền) được quy định như thế nào?
Căn cứ theo quy định tại Mẫu 06A Phụ lục I ban hành kèm Thông tư 21/2018/TT-BYT quy định về mẫu tóm tắt sản phẩm đề nghị cấp giấy đăng ký lưu hành đối với thuốc cổ truyền (không bao gồm vị thuốc cổ truyền) như sau:
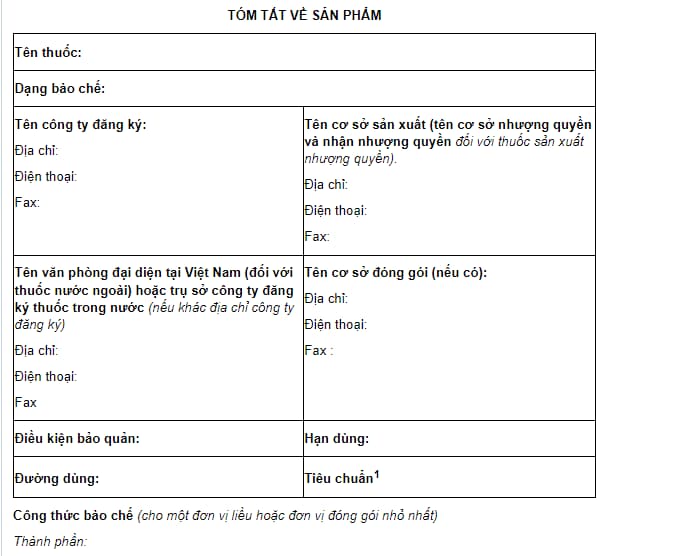
Xem toàn bộ mẫu tóm tắt sản phẩm đề nghị cấp giấy đăng ký lưu hành đối với thuốc cổ truyền (không bao gồm vị thuốc cổ truyền) tại Mẫu 06A Phụ lục I ban hành kèm Thông tư 21/2018/TT-BYT.

Mẫu tóm tắt sản phẩm đề nghị cấp giấy đăng ký lưu hành đối với thuốc cổ truyền (không bao gồm vị thuốc cổ truyền) được quy định như thế nào? (Hình từ Internet)
Quy định về sáng chế và bảo mật liên quan đến thuốc cổ truyền đăng ký?
Căn cứ theo quy định tại Điều 6 Thông tư 21/2018/TT-BYT quy định về sáng chế và bảo mật liên quan đến thuốc cổ truyền đăng ký như sau:
Sáng chế và bảo mật liên quan đến thuốc cổ truyền đăng ký
Cơ sở đăng ký thuốc cổ truyền có nhu cầu bảo mật dữ liệu đối với hồ sơ đăng ký thuốc cổ truyền mới theo quy định tại Thông tư số 05/2010/TT-BYT ngày 01/3/2010 của Bộ trưởng Bộ Y tế hướng dẫn bảo mật dữ liệu thử nghiệm trong đăng ký thuốc phải nêu rõ đề nghị trong đơn đề nghị cấp, gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành theo các Mẫu số 03, Mẫu số 04 và Mẫu số 05 Phụ lục I ban hành kèm theo Thông tư này và cung cấp các tài liệu pháp lý có liên quan đến tình trạng bảo hộ độc quyền sở hữu trí tuệ (văn bằng độc quyền sáng chế).
Theo đó, cơ sở đăng ký thuốc cổ truyền có nhu cầu bảo mật dữ liệu đối với hồ sơ đăng ký thuốc cổ truyền mới theo quy định tại Thông tư 05/2010/TT-BYT.
Xác định thuốc cổ truyền được miễn thử lâm sàng tại Việt Nam phải dự trên những tiêu chí nào?
Căn cứ theo quy định tại Điều 7 Thông tư 21/2018/TT-BYT được sửa đổi bởi khoản 10 Điều 1 Thông tư 39/2021/TT-BYT quy định về tiêu chí xác định thuốc cổ truyền được miễn thử lâm sàng tại Việt Nam như sau:
Trường hợp thuốc cổ truyền được miễn thử lâm sàng tại Việt Nam
1. Thuốc cổ truyền được Bộ Y tế công nhận miễn thử lâm sàng bao gồm các thuốc có nguồn gốc, xuất xứ công thức thuộc các trường hợp sau:
a) Vị thuốc cổ truyền;
b) Cổ phương;
c) Bài thuốc gia truyền đã được cấp giấy chứng nhận bài thuốc gia truyền theo quy định của pháp luật, có tác dụng, chỉ định thể hiện rõ được thể bệnh y học cổ truyền, đã được thử độc tính cấp và bán trường diễn để bảo đảm an toàn, hiệu quả;
d) Thuốc cổ truyền đã được miễn thử lâm sàng có thay đổi dạng bào chế nhưng không thay đổi thành phần, hàm lượng, chỉ định, tác dụng và đường dùng; đã được thử độc tính cấp và bán trường diễn để bảo đảm an toàn, hiệu quả;
đ) Cổ phương gia giảm có tài liệu, dữ liệu chứng minh hoặc phân tích, biện giải việc gia giảm phù hợp với lý luận của y học cổ truyền. Trường hợp gia giảm mà thành phần có dược liệu thuộc danh mục dược liệu độc do Bộ trưởng Bộ Y tế ban hành thì phải thử độc tính cấp, bán trường diễn để bảo đảm an toàn, hiệu quả;
e) Là sản phẩm thuộc đề tài nghiên cứu khoa học cấp tỉnh và tương đương trở lên về thuốc cổ truyền được nghiệm thu đề tài do Hội đồng khoa học của tỉnh/thành phố xét duyệt và Ủy ban nhân dân tỉnh/thành phố ra quyết định hoặc do Bộ chủ quản ngành xét duyệt theo quy hiện hành; có tác dụng, chỉ định thể hiện rõ được thể bệnh y học cổ truyền và đã được thử độc tính cấp, bán trường diễn và tác dụng dược lý để bảo đảm an toàn, hiệu quả, trừ trường hợp quy định tại Điều 10 Thông tư này;
g) Thuốc cổ truyền có chỉ định dựa trên dữ liệu nghiên cứu lâm sàng theo quy định về thử thuốc trên lâm sàng của Bộ Y tế đã được cấp giấy đăng ký lưu hành và lưu hành trên 10 năm trở lên, không phát hiện thêm các tác dụng không mong muốn và phản ứng có hại của thuốc hoặc thuốc cổ truyền chưa có dữ liệu lâm sàng đã được cấp giấy đăng ký lưu hành và lưu hành trên 5 năm trở lên, không phát hiện thêm các tác dụng không mong muốn và phản ứng có hại của thuốc hoặc thuốc cổ truyền;
h) Gia giảm từ những bài thuốc đã được cấp giấy đăng ký lưu hành và lưu hành trên thị trường 5 năm trở lên, trừ các thuốc cổ truyền có chỉ định dựa trên dữ liệu nghiên cứu lâm sàng theo quy định về thử thuốc trên lâm sàng của Bộ Y tế, không phát hiện thêm các tác dụng không mong muốn và phản ứng có hại của thuốc; có tài liệu, dữ liệu chứng minh hoặc phân tích, biện giải việc gia giảm phù hợp với lý luận của y học cổ truyền.
2. Thuốc cổ truyền gia hạn từ những thuốc đã được cấp giấy đăng ký lưu hành trước ngày Luật Dược số 105/2016/QH13 có hiệu lực, trừ thuốc có đề nghị phải thử lâm sàng của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc cổ truyền, dược liệu khi lưu hành phát hiện thêm các tác dụng không mong muốn và phản ứng có hại của thuốc.
Theo đó, thuốc cổ truyền được miễn thử lâm sàng tại Việt Nam trong các trường hợp nêu trên.


Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.
- Đề thi minh họa lớp 10 môn Văn chuyên Trường Phổ thông Năng khiếu (có đáp án)?
- Hoàn tất xác thực KYC là gì? Cách xác minh KYC Pi Network 2025 chi tiết?
- Quy định về trọng điểm phòng không nhân dân từ 01/07/2025?
- 27 tháng 2 âm lịch là ngày mấy dương 2025? Chửi thề gây ảnh hưởng đến không khí trang nghiêm của lễ hội vào ngày 27 tháng 2 2025 âm lịch bị xử phạt bao nhiêu?
- Chiến tranh thế giới thứ nhất diễn ra từ năm nào đến năm nào?








