1. MỤC ĐÍCH
Quy trình này nhằm thống nhất việc giải
quyết hồ sơ trực tuyến đề nghị cấp Giấy xác nhận nội dung thông tin thuốc theo
hình thức phát hành tài liệu thông tin thuốc; đề nghị cấp Giấy xác nhận nội
dung quảng cáo thuốc và tạo thuận lợi cho công tác kiểm tra, đánh giá việc giải
quyết hồ sơ đề nghị cấp Giấy xác nhận nội dung thông tin thuốc theo hình thức
phát hành tài liệu thông tin thuốc; đề nghị cấp Giấy xác nhận nội dung quảng
cáo thuốc.
2. PHẠM VI ÁP DỤNG
- Giải quyết hồ sơ đề nghị cấp Giấy xác
nhận nội dung thông tin thuốc theo hình thức phát hành tài liệu thông tin thuốc;
đề nghị cấp Giấy xác nhận nội dung quảng cáo thuốc trên phần mềm tiếp nhận và
giải quyết thủ tục xác nhận nội dung thông tin, quảng cáo thuốc trên Hệ thống dịch
vụ công trực tuyến tại địa chỉ truy cập: https://dichvucong.dav.gov.vn.
3. TÀI LIỆU
THAM CHIẾU
- Luật dược
số 105/2016/QH13 ngày 06 tháng 4 năm 2016.
- Luật quảng
cáo số 16/2012/QH13 ngày 21 tháng 6 năm 2012.
- Nghị định số 54/2017/NĐ-CP ngày 08 tháng 5 năm 2017 của Chính
phủ quy định chi tiết một số điều và biện pháp thi hành Luật dược.
- Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 sửa đổi, bổ sung
một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý
nhà nước của Bộ Y tế.
- Quyết định số 5496/QĐ-BYT ngày
24/12/2015 của Bộ trưởng Bộ Y tế về việc triển khai dịch vụ công trực tuyến mức
độ 4 tiếp nhận hồ sơ đăng ký thông tin thuốc, xác nhận nội dung quảng cáo thuốc.
- Quyết định số 372/QĐ-QLD ngày
01/7/2022 về việc quy định chức năng, nhiệm vụ, quyền hạn của Văn phòng và các
phòng thuộc Cục Quản lý Dược.
- Sổ tay hướng dẫn thông tin, quảng cáo
thuốc.
- Quy chế hoạt động của chuyên gia thẩm
định hồ sơ đề nghị xác nhận nội dung thông tin thuốc, hồ sơ đề nghị xác nhận nội
dung quảng cáo thuốc tiếp nhận trên Hệ thống Dịch vụ công trực tuyến tại địa chỉ
truy cập: https://dichvucong.dav.gov.vn
4. TRÁCH NHIỆM THỰC HIỆN
- Lãnh đạo chất lượng, Ban QMS, Lãnh đạo
phòng Quản lý Kinh doanh Dược có trách nhiệm kiểm tra và bảo đảm những
quy định trong Quy trình này được thực hiện và tuân thủ.
- Lãnh đạo Cục, Lãnh đạo phòng QLKD Dược
và các chuyên viên, chuyên gia của Phòng QLKD Dược, Bộ phận Một cửa - Cục Quản
lý Dược, chuyên gia thẩm định liên quan đến quy trình có trách nhiệm thực hiện
và tuân thủ những quy định tại Quy trình này.
- Lãnh đạo các phòng, đơn vị có trách
nhiệm phối hợp, kiểm tra và bảo đảm những quy định tại Quy trình này được thực
hiện và tuân thủ.
- Phòng Đăng ký thuốc có trách nhiệm cập
nhật dữ liệu thuốc đã có Quyết định thu hồi giấy đăng ký lưu hành của Cục Quản
lý Dược, dữ liệu thuốc đã có công văn khuyến cáo của Cục Quản lý Dược và chia sẻ
dữ liệu này để đảm bảo căn cứ pháp lý trong việc giải quyết hồ sơ đề nghị cấp
Giấy xác nhận nội dung thông tin, quảng cáo thuốc theo đúng quy định của pháp luật.
5. QUY ĐỊNH CHUNG; GIẢI
THÍCH TỪ NGỮ VÀ CHỮ VIẾT TẮT
5.1. Quy định chung:
5.1.1. Thẩm định đối với nội dung quảng
cáo thuốc đề nghị xác nhận trên các phương tiện quảng cáo như báo nói, báo
hình, báo điện tử, trang thông tin điện tử, màn hình chuyên quảng cáo và các
phương tiện quảng cáo khác theo quy định pháp luật về quảng cáo có âm thanh,
hình ảnh chuyển động (sau đây gọi tắt là phương tiện báo nói, báo
hình),
bao gồm:
- Thẩm định kịch bản: các chuyên gia
tiến hành thẩm định độc lập và nhập ý kiến vào Hệ thống.
- Thẩm định bản ghi hình/bản ghi âm: các chuyên gia
tiến hành thẩm định độc lập cùng với kịch bản và nhập ý kiến vào Hệ thống.
5.1.2. Thẩm định nội dung thông tin thuốc,
quảng cáo thuốc trên các phương tiện quảng cáo khác:
Các chuyên gia tiến hành thẩm định độc lập
và nhập ý kiến vào Hệ thống.
5.1.3. Toàn bộ quá trình tiếp
nhận, xem xét và cấp giấy xác nhận nội dung thông tin thuốc theo hình thức phát
hành tài liệu thông tin thuốc, quảng cáo thuốc được thực hiện trực tuyến thông
qua phần mềm tiếp nhận và
giải quyết thủ tục xác nhận nội dung thông tin, quảng cáo thuốc trên Hệ thống
phần mềm dịch vụ công trực tuyến của Cục Quản lý Dược tại địa chỉ truy cập: https://dichvucong.dav.gov.vn.
Mỗi cá nhân tham gia vào Quy trình được
cấp một tài khoản để thực hiện công việc tác nghiệp và có trách nhiệm giữ gìn mật
khẩu để đảm bảo tính bảo mật của Hệ thống. Văn phòng Cục là đầu mối quản lý việc cấp
tài khoản công tác.
Các cá nhân, tổ chức liên quan đến quy
trình thực hiện theo quy định của pháp luật về an toàn thông tin mạng.
5.2. Giải thích từ ngữ và chữ viết tắt:
5.2.1. Giải thích từ ngữ:
- Lãnh đạo Cục: Lãnh đạo Cục được phân
công phụ trách.
- Lãnh đạo Phòng được ủy quyền: Phó Trưởng
phòng Quản lý Kinh doanh dược được Trưởng phòng ủy quyền.
- Lãnh đạo Phòng: Lãnh đạo Phòng được
phân công phụ trách lĩnh vực.
- Chuyên viên thụ lý: Chuyên viên,
chuyên gia của Phòng Quản lý Kinh doanh dược được phân công phụ trách hồ sơ.
5.2.2. Chữ viết tắt:
- Cục QLD: Cục Quản lý Dược
- Phòng QLKD Dược: Phòng Quản lý kinh
doanh dược
- Hệ thống: Hệ thống cấp giấy xác nhận nội
dung thông tin, quảng cáo thuốc trực tuyến
- VT/VP/LĐ: Văn thư/ Văn phòng/ Lãnh đạo
- BPMC: Bộ phận một cửa
- GXN: Giấy xác nhận
- TTQCT: thông tin, quảng cáo thuốc
- SĐ/BS: Sửa đổi, bổ sung
- BN/BH/BĐT/Web: Báo nói/Báo hình/Báo điện
tử/Trang thông tin điện tử
- CVTL: Chuyên viên thụ lý.
6. NỘI DUNG QUY TRÌNH
6.1. Sơ đồ quy trình thẩm định hồ sơ đề
nghị cấp Giấy xác nhận nội dung thông tin thuốc theo hình thức phát hành tài liệu
thông tin thuốc; đề nghị xác nhận nội dung quảng cáo thuốc
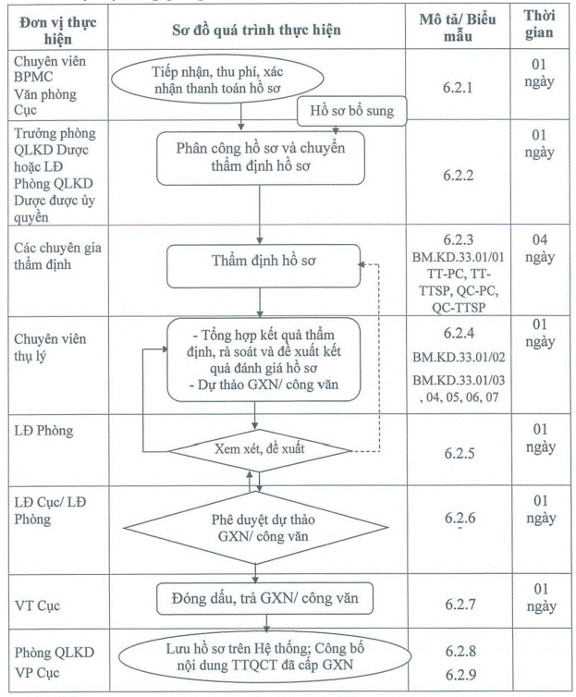
6.2. Mô tả quy trình
6.2.1. Tiếp nhận, thu phí xác nhận thanh
toán phí hồ sơ (Chỉ áp dụng với hồ sơ lần đầu, hồ sơ SĐ/BS thực hiện từ
bước 6.2.2; Thời gian thực hiện bước này tối đa là 01 ngày, không kể thời gian
thực hiện ở phía doanh nghiệp)
- Việc tiếp nhận hồ sơ thực hiện theo
Quy trình tiếp nhận và bàn giao hồ sơ tại Bộ phận một cửa của Văn phòng Cục.
- Việc thu phí, xác nhận thanh toán phí
thực hiện theo Quy trình thu phí, lệ phí của Văn phòng Cục.
6.2.2. Phân công và chuyển thẩm định hồ
sơ
(Thời gian thực hiện bước này tối đa là 01 ngày)
Trưởng phòng hoặc Lãnh đạo phòng được ủy
quyền phân công hồ sơ cho chuyên viên thụ lý và chuyển hồ sơ cho tất cả chuyên
gia trong các tiểu ban thẩm định (Đối với cả hồ sơ lần đầu và hồ sơ bổ sung).
6.2.3. Thẩm định hồ sơ của chuyên gia (Thời gian
thực hiện bước này tối đa là 04 ngày)
* Chuyên gia thẩm định tiến hành thẩm định
hồ sơ theo các quy định hiện hành, Quy chế hoạt động của chuyên gia và hướng dẫn
tại Sổ tay thông tin, quảng cáo thuốc theo các Biểu mẫu:
- Đối với hồ sơ thông tin: Biểu mẫu BM.KD.33.01/01TT-PC, BM.KD.33.01/01TT-TTSP.
- Đối với hồ sơ quảng cáo: Biểu mẫu BM.KD.33.01/01QC-PC, BM.KD.33.01/01QC-TTSP.
Sau khi hoàn thành việc thẩm định,
chuyên gia thẩm định ấn vào nút “Hoàn thành thẩm định”.
* Trường hợp LĐ Phòng QLKD Dược trên cơ
sở ý kiến đề xuất của chuyên viên thụ lý trao đổi ý kiến với chuyên gia: Chuyên
gia ghi ý kiến thẩm định lại và chuyển lại chuyên viên thụ lý để thực hiện theo
bước 6.2.4.
Thời gian thực hiện cho bước trao đổi lại
ý kiến này tối đa là 02 ngày.
6.2.4. Tổng hợp kết quả thẩm định, rà
soát và đề xuất kết quả đánh giá hồ sơ, dự thảo giấy xác nhận/công văn (Thời gian
thực hiện bước này tối đa là 01 ngày)
* Sau khi chuyên gia ở mỗi tiểu ban đã
thẩm định nội dung thông tin, quảng cáo thuốc, căn cứ kết quả thẩm định của các
chuyên gia, chuyên viên thụ lý: (1) Tổng hợp ý kiến thẩm định chuyên gia; (2)
Rà soát thêm một số tiêu chí liên quan đến điều kiện đối với thuốc được quảng
cáo được quy định tại Khoản 2 Điều 79 Luật dược 2016; (3) Đề
xuất ý kiến đánh giá hồ sơ trên cơ sở ý kiến thẩm định của chuyên gia và nội
dung rà soát của chuyên viên (thực hiện trên Phiếu đánh giá hồ sơ theo Biểu mẫu
BM.KD.33.01/02).
* Sau đó, chuyên viên thụ lý dự thảo giấy
xác nhận/công văn tương ứng:
- Soạn thảo Giấy xác nhận nội dung thông
tin, quảng cáo thuốc theo biểu mẫu
BM.KD.33.01/04 hoặc BM.KD.33.01/05 và
đính kèm nội dung thông tin/quảng cáo được xác nhận hoặc;
- Soạn thảo công văn yêu cầu cơ sở bổ
sung, sửa đổi nội dung thông tin, quảng cáo thuốc theo biểu mẫu BM.KD.33.01/03 (chỉ áp dụng đối với
trường hợp hồ sơ nộp lần đầu) hoặc;
- Soạn thảo công văn thông báo không xác
nhận nội dung thông tin, quảng cáo thuốc theo biểu mẫu BM.KD.33.01/06 (đối với trường hợp
hồ sơ nộp lần đầu) hoặc BM.KD.33.01/07 (đối với trường hợp hồ sơ sửa đổi, bổ
sung).
Cuối cùng, chuyên viên thụ lý ấn vào nút
“Chuyển hồ sơ” để trình LĐ Phòng và chuyển sang bước 6.2.5.
* Trường hợp có ý kiến chưa thống nhất về
cùng một nội dung đề nghị giữa các chuyên gia/ tiểu ban, chuyên viên thụ lý
tích vào mục “Đề xuất trao đổi lại với chuyên gia” và ghi rõ nội dung cần trao
đổi lại với chuyên gia để báo cáo, đề xuất với Lãnh đạo Phòng. Sau khi chuyên
gia đã có ý kiến trao đổi lại thì chuyên viên thụ lý sẽ tổng hợp và có ý kiến đề
xuất kết quả đánh giá hồ sơ.
* Trường hợp LĐ Phòng QLKD Dược trên cơ
sở ý kiến đề xuất của chuyên viên thụ lý đã trao đổi lại với chuyên gia nhưng
chuyên gia vẫn bảo lưu ý kiến ban đầu: chuyên viên thụ lý có thể xem xét, đề xuất
Lãnh đạo Phòng lấy thêm ý kiến chuyên gia khác ngoài các chuyên gia đã thẩm định
hồ sơ nhưng trong cùng tiểu ban để có thêm căn cứ đánh giá hồ sơ.
* Chuyên viên thụ lý cũng có thể đề xuất
các ý kiến độc lập của mình (nếu có).
6.2.5. Lãnh đạo Phòng xem xét, đề xuất (Thời gian
thực hiện bước này tối đa là 01 ngày, trong trường hợp cần trao đổi ý kiến với
chuyên gia thẩm định hoặc lấy thêm ý kiến chuyên gia khác: thời gian thực hiện
sẽ được cộng thêm thời gian trao đổi hoặc lấy thêm ý kiến
chuyên gia, tối đa 02 ngày)
Trên cơ sở ý kiến đề xuất kết quả đánh
giá hồ sơ của chuyên viên thụ lý, LĐ Phòng thực hiện như sau:
* Trường hợp nhất trí với ý kiến của
chuyên viên thụ lý mà không thuộc trường hợp cần trao đổi lại với chuyên gia thẩm
định: LĐ Phòng tích vào ô “Nhất trí ý kiến của chuyên viên”, tích chọn vào ô
tương ứng tại mục Đề xuất của Phòng QLKD Dược trên Phiếu đánh giá hồ sơ (“Hồ sơ
đạt” hoặc “Hồ sơ cần sửa đổi, bổ sung” hoặc “Hồ sơ không đạt”); sau đó chọn nút
“Chuyển Lãnh đạo Cục” và chuyển sang bước 6.2.6.
* Trường hợp nhất trí ý kiến của chuyên
viên thụ lý về việc đề xuất trao đổi lại với chuyên gia thẩm định: LĐ Phòng
tích vào ô “Nhất trí đề xuất trao đổi lại với các chuyên gia”; sau đó chọn nút
“Chuyển lại chuyên gia” để chuyên gia thẩm định thực hiện lại theo bước 6.2.3.
* Trường hợp chưa nhất trí với ý kiến của
chuyên viên thụ lý: LĐ Phòng tích vào ô “Chưa nhất trí ý kiến của chuyên viên”
và ghi rõ ý kiến của mình; sau đó chọn nút “Chuyển lại chuyên viên” để chuyên
viên thụ lý thực hiện lại theo bước 6.2.4.
Đối với trường hợp cần trao đổi lại với
chuyên gia thẩm định, thực hiện theo nguyên tắc:
- Chuyên viên thụ lý tổng hợp ý kiến của
các Tiểu ban và trình Phó Trưởng phòng phụ trách xem xét. Trường hợp có ý kiến
không thống nhất giữa các Tiểu ban hoặc chuyên viên thụ lý có ý kiến khác với ý
kiến của các chuyên gia, chuyên viên thụ lý báo cáo và đề xuất với Phó Trưởng
phòng phụ trách trao đổi lại với các chuyên gia để kiểm tra, rà soát lại.
- Phó Trưởng phòng phụ trách ghi ý kiến
cuối cùng về nội dung thẩm định hồ sơ thông tin, quảng cáo thuốc trong Biên bản
thẩm định Hồ sơ trên cơ sở ý kiến của các chuyên gia và ý kiến tổng hợp của
chuyên viên thụ lý hồ sơ. Trường hợp chưa thống nhất với ý kiến thẩm định của
chuyên gia, Phó Trưởng phòng phụ trách chuyển lại để chuyên gia kiểm tra, thẩm
định lại. Trường hợp chuyên gia vẫn giữ
nguyên ý kiến, Phó Trưởng phòng phụ trách ghi ý kiến cuối cùng hoặc báo cáo Trưởng
phòng để Trưởng phòng xem xét, cho ý kiến cuối cùng hoặc đề nghị tổ chức họp với
nhóm chuyên gia.
6.2.6. Phê duyệt dự thảo giấy xác nhận/
công văn
(Thời gian thực hiện bước này tối đa là 01 ngày)
Trên cơ sở ý kiến kết luận của Phòng
QLKD Dược ghi tại Phiếu đánh giá hồ sơ, LĐ Cục thực hiện như sau:
* Trường hợp nhất trí với ý kiến của
Phòng QLKD Dược: LĐ Cục ký giấy xác nhận hoặc công văn yêu cầu sửa đổi, bổ sung
hoặc công văn thông báo không xác nhận; sau đó chọn “Chuyển Văn thư Cục” và ấn
vào nút “Chuyển hồ sơ” để chuyển tới bộ phận Văn thư Cục và chuyển sang bước
6.2.7.
* Trường hợp chưa nhất trí với ý kiến của
Phòng QLKD Dược: LĐ Cục tích vào ô “Chưa nhất trí ý kiến của Phòng QLKD Dược”
và ghi rõ ý kiến của mình; sau đó chọn nút “Chuyển lại Phòng QLKD Dược” đề
Phòng QLKD Dược thực hiện lại theo bước 6.2.5.
* Trường hợp LĐ Phòng QLKD Dược được Cục
trưởng phân công ký thừa lệnh công văn thông báo về việc yêu cầu bổ sung, sửa đổi
hồ sơ đề nghị cấp Giấy xác nhận nội dung thông tin, quảng cáo thuốc hoặc công
văn thông báo về việc không cấp Giấy xác nhận nội dung thông tin, quảng cáo thuốc;
ký thừa ủy quyền Giấy xác nhận nội dung thông tin, quảng cáo thuốc: LĐ Phòng
QLKD Dược thực hiện bước 6.2.6 này.
6.2.7. Đóng dấu giấy xác nhận/ công văn (Thời gian
thực hiện bước này tối đa là 01 ngày)
Văn thư Cục đóng dấu số vào giấy xác nhận/
công văn yêu cầu sửa đổi, bổ sung/ công văn thông báo không xác nhận sau khi được
LĐ Cục/ LĐ Phòng QLKD Dược phê duyệt và ấn vào nút “Trả hồ sơ” để chuyển giấy
xác nhận/ công văn này đến tài khoản của cơ sở trên Hệ thống.
6.2.8. Công bố nội dung thông tin, quảng
cáo thuốc đã xác nhận
Đối với các mẫu nội dung thông tin, quảng
cáo thuốc đã được Cục QLD phê duyệt và cấp Giấy xác nhận, Phòng Quản lý Kinh
doanh dược phối hợp Văn phòng Cục và đơn vị cung cấp dịch vụ công nghệ thông
tin của Cục QLD trích xuất dữ liệu giấy xác nhận kèm theo nội dung thông tin/
quảng cáo thuốc được xác nhận và tiến hành công bố trên trang thông tin điện tử
của Cục QLD theo Quy trình đăng tải thông tin trên trang điện tử của Cục QLD.
6.2.9. Lưu, bảo quản hồ sơ
Hồ sơ được lưu trữ trên Hệ thống trực
tuyến.
7. HỒ SƠ CỦA QUY TRÌNH
- Hồ sơ đề nghị cấp Giấy xác nhận nội
dung thông tin thuốc, quảng cáo thuốc của cơ sở;
- Công văn yêu cầu bổ sung, sửa đổi (nếu
có);
- Các nội dung bổ sung, sửa đổi của cơ sở
(nếu có);
- Giấy xác nhận hoặc công văn trả lời
không xác nhận nội dung thông tin thuốc, quảng cáo thuốc.
8. BIỂU MẪU
- BM.KD.33.01/01TT-PC: Biên bản thẩm
định pháp chế hồ sơ đề nghị cấp Giấy xác nhận nội dung thông tin thuốc.
- BM.KD.33.01/01TT-TTSP: Biên bản
thẩm định thông tin sản phẩm hồ sơ đề nghị cấp Giấy xác nhận nội dung thông tin
thuốc.
- BM.KD.33.01/01QC-PC: Biên bản thẩm
định pháp chế hồ sơ đề nghị cấp Giấy xác nhận nội dung quảng cáo thuốc.
- BM.KD.33.01/01QC-TTSP: Biên bản
thẩm định thông tin sản phẩm hồ sơ đề nghị cấp Giấy xác nhận nội dung quảng cáo
thuốc.
- BM.KD.33.01/02:
Phiếu đánh giá hồ sơ thông tin/ quảng cáo thuốc.
- BM.KD.33.01/03:
Công văn yêu cầu bổ sung, sửa đổi nội dung đăng ký thông tin thuốc.
- BM.KD.33.01/04:
Giấy xác nhận nội dung thông tin thuốc theo hình thức phát hành tài liệu thông
tin thuốc/quảng cáo thuốc (trừ trường hợp quảng cáo thuốc theo phương tiện tổ
chức hội thảo, hội nghị, sự kiện giới thiệu thuốc).
- BM.KD.33.01/05:
Giấy xác nhận nội dung quảng cáo thuốc theo phương tiện tổ chức hội thảo, hội
nghị, sự kiện giới thiệu thuốc.
- BM.KD.33.01/06:
Công văn thông báo không xác nhận nội dung thông tin thuốc, quảng cáo thuốc.
- BM.KD.33.01/07:
Công văn thông báo không xác nhận nội dung thông tin thuốc, quảng cáo thuốc do
không đáp ứng yêu cầu bổ sung, sửa đổi nội dung thông tin thuốc, quảng cáo thuốc.
BM.KD.33.01/01TT-PC:
Mẫu Biên bản thẩm định Pháp chế hồ sơ đề nghị cấp Giấy xác nhận nội dung thông
tin thuốc
1. CÁC NỘI DUNG THẨM ĐỊNH
|
Tên mục
|
Nội dung
|
Đề xuất
|
Ghi chú
|
|
Đạt
|
Bổ sung
|
Không đạt
|
Không YC
|
|
1
|
Đơn đề nghị xác nhận nội dung thông
tin thuốc: theo Mẫu số 01 Phụ lục VI của Nghị định số 54/2017/NĐ-CP
|
|
|
|
|
|
|
2
|
Giấy phép thành lập văn phòng đại diện
của công ty nước ngoài tại Việt Nam đối với cơ sở nước ngoài đứng tên đề nghị
xác nhận nội dung thông tin thuốc hoặc Giấy chứng nhận đủ điều
kiện kinh doanh dược đối với cơ sở kinh doanh dược của Việt Nam đứng tên đề
nghị xác nhận nội dung thông tin thuốc
|
|
|
|
|
|
|
3
|
Giấy ủy quyền của cơ sở đăng ký thuốc
cho cơ sở đứng tên trên hồ sơ đề nghị xác nhận nội dung thông tin thuốc trong
trường hợp ủy quyền
|
|
|
|
|
|
|
4
|
Giấy đăng ký lưu hành thuốc còn hiệu lực
|
|
|
|
|
|
|
5
|
Mẫu nhãn và tờ hướng dẫn sử dụng thuốc
hiện hành đã được Bộ Y tế phê duyệt
|
|
|
|
|
Được coi là đạt yêu cầu
nếu đã có dấu của Cục
Quản lý Dược và nội dung tự cập nhật theo quy định tại Khoản 6
Điều 38 Thông tư số 08/2022/TT-BYT và Khoản 3 Điều 38
Thông tư số 01/2018/TT-BYT (nếu có)
|
|
6
|
Nội dung thông tin đề nghị xác nhận:
- Các nội dung tại Khoản
2 Điều 112 Nghị định số 54/2017/NĐ-CP
- lo go, khẩu hiệu, thương hiệu của cơ
sở đăng ký, sản xuất, phân phối thuốc; ký hiệu ® - thương hiệu
đã đăng ký bảo hộ (nếu có)
|
|
|
|
|
|
|
7
|
Nội dung khác chưa đạt (nếu có đề nghị
ghi rõ):
|
|
Ngày thẩm định
|
Họ và tên
chuyên gia
|
Chữ ký
|
Kết quả thẩm
định
|
Ghi chú
|
|
|
|
|
Đạt □
|
|
|
Cần sửa đổi, bổ sung □
|
Ghi rõ lý do
(Chỉ áp dụng với hồ sơ nộp lần đầu)
|
|
Không đạt □
|
Ghi rõ lý do
|
BM.KD.33.01/01TT-TTSP:
Mẫu Biên bản thẩm định Thông tin sản phẩm hồ sơ đề nghị cấp Giấy xác nhận nội
dung thông tin thuốc
1. CÁC NỘI DUNG THẨM ĐỊNH
|
Tên mục
|
Nội dung
|
Đề xuất
|
Ghi chú
|
|
Đạt
|
Bổ sung
|
Không đạt
|
Không YC
|
|
1
|
Nội dung thông tin đề nghị xác nhận
(Bao gồm có đầy đủ nội dung thông tin thuốc theo quy định tại điểm
a khoản 5 Điều 76 của Luật dược)
|
|
|
|
|
|
|
2
|
Tài liệu tham khảo có liên quan đến nội
dung thông tin thuốc đề nghị xác nhận (nếu có);
|
|
|
|
|
|
|
3
|
Nội dung khác chưa đạt (nếu có đề nghị
ghi rõ):
|
|
Ngày thẩm định
|
Họ và tên
chuyên gia
|
Chữ ký
|
Kết quả thẩm
định
|
Ghi chú
|
|
|
|
|
Đạt □
|
|
|
Cần sửa đổi, bổ sung □
|
Ghi rõ lý do
(Chỉ áp dụng với hồ sơ nộp lần đầu)
|
|
Không đạt □
|
Ghi rõ lý do
|
BM.KD.33.01/01QC-PC:
Mẫu Biên bản thẩm định Pháp chế hồ sơ đề nghị cấp Giấy xác nhận nội dung quảng
cáo thuốc
1. CÁC NỘI DUNG THẨM ĐỊNH
|
Tên mục
|
Nội dung
|
Đề xuất
|
Ghi chú
|
|
Đạt
|
Bổ sung
|
Không đạt
|
Không YC
|
|
1
|
Đơn đề nghị xác nhận nội dung quảng cáo thuốc:
theo Mẫu số 01 Phụ lục VI của Nghị định số 54/2017/NĐ-CP
hoặc Mẫu số 02 Phụ lục VI của Nghị định số 54/2017/NĐ-CP.
|
|
|
|
|
|
|
2
|
Giấy phép thành lập văn phòng đại diện
của công ty nước ngoài tại Việt Nam đối với cơ sở nước ngoài đứng tên đề nghị
xác nhận nội dung quảng cáo thuốc
hoặc Giấy chứng nhận đủ điều kiện kinh doanh dược đối với cơ sở kinh doanh dược
của Việt Nam đứng tên đề nghị xác nhận nội dung quảng cáo thuốc
|
|
|
|
|
|
|
3
|
Giấy ủy quyền của cơ sở đăng ký thuốc
cho cơ sở đứng tên trên hồ sơ đề nghị xác nhận nội dung quảng cáo thuốc
trong trường hợp ủy quyền
|
|
|
|
|
|
|
4
|
Giấy đăng ký lưu hành thuốc còn hiệu lực
|
|
|
|
|
|
|
5
|
Mẫu nhãn và tờ hướng dẫn sử dụng thuốc
hiện hành đã được Bộ Y tế phê duyệt
|
|
|
|
|
Được coi là đạt yêu cầu
nếu đã có dấu của Cục
Quản lý Dược và nội
dung tự cập nhật theo quy định
tại Khoản 6 Điều 38 Thông tư số 08/2022/TT-BYT và Khoản 3 Điều 38 Thông tư số 01/2018/TT-BYT (nếu có)
|
|
6
|
Thuốc đáp ứng điều kiện quảng cáo thuốc
quy định tại khoản 2 Điều 79 Luật dược 2016
|
|
|
|
|
|
|
7
|
Nội dung quảng cáo thuốc đề nghị xác
nhận (mẫu thiết kế nội dung quảng cáo và bản ghi âm, ghi hình (đối với
phương tiện báo nói, báo hình hoặc thiết bị điện tử, màn hình
chuyên quảng cáo và các
phương tiện quảng cáo khác theo quy định pháp luật về quảng cáo có âm
thanh, hình ảnh chuyển động)):
- Các nội dung tại Khoản
2 Điều 112 Nghị định số 54/2017/NĐ-CP
- lo go, khẩu hiệu, thương hiệu của cơ
sở đăng ký, sản xuất, phân phối thuốc; ký hiệu ® - thương hiệu
đã đăng ký bảo hộ (nếu có)
|
|
|
|
|
|
|
8
|
Nội dung khác chưa đạt (nếu có đề nghị ghi
rõ):
|
|
Ngày thẩm định
|
Họ và tên
chuyên gia
|
Chữ ký
|
Kết quả thẩm
định
|
Ghi chú
|
|
|
|
|
Đạt □
|
|
|
Cần sửa đổi, bổ sung □
|
Ghi rõ lý do
(Chỉ áp dụng với hồ sơ nộp lần đầu)
|
|
Không đạt □
|
Ghi rõ lý do
|
BM.KD.33.01/01QC-TTSP:
Mẫu Biên bản thẩm định Thông tin sản phẩm hồ sơ đề nghị cấp Giấy xác nhận nội
dung quảng cáo thuốc
1. CÁC NỘI DUNG THẨM ĐỊNH
|
Tên mục
|
Nội dung
|
Đề xuất
|
Ghi chú
|
|
Đạt
|
Bổ sung
|
Không đạt
|
Không YC
|
|
1
|
Nội dung quảng cáo thuốc đề nghị xác
nhận (mẫu thiết kế nội dung quảng cáo và bản ghi âm, ghi hình (đối với
phương tiện báo nói, báo hình hoặc thiết bị điện tử, màn hình chuyên quảng
cáo và các phương tiện quảng cáo khác theo quy định pháp luật về quảng cáo có âm thanh,
hình ảnh chuyển động)
|
|
|
|
|
|
|
2
|
Tài liệu tham khảo có liên quan đến nội
dung quảng cáo thuốc đề nghị xác nhận (nếu có);
|
|
|
|
|
|
|
3
|
Nội dung khác chưa đạt (nếu có đề nghị
ghi rõ):
|
|
Ngày thẩm định
|
Họ và tên
chuyên gia
|
Chữ ký
|
Kết quả thẩm
định
|
Ghi chú
|
|
|
|
|
Đạt □
|
|
|
Cần sửa đổi, bổ sung □
|
Ghi rõ lý do
(Chỉ áp dụng với hồ sơ nộp lần đầu)
|
|
Không đạt □
|
Ghi rõ lý do
|
BM.KD.33.01/02:
|
|
PHIẾU ĐÁNH
GIÁ HỒ SƠ THÔNG TIN/QUẢNG CÁO THUỐC
|
|
TT
|
Nội dung
|
Đáp ứng
|
Chưa đáp ứng
|
Căn cứ rà
soát/đối chiếu
|
Nội dung chi tiết
|
|
I
|
Nội dung thẩm định
của chuyên gia
|
Hệ thống tự động nhập
ý kiến của các chuyên gia
1. Tiểu ban Pháp chế
2. Tiểu ban Thông tin
sản phẩm
|
|
II
|
Nội dung rà soát
|
|
|
|
|
|
1
|
Thuốc có bị thu hồi giấy đăng ký lưu
hành
|
|
|
Căn cứ trên dữ liệu thuốc đã có Quyết
định thu hồi GĐKLH của Cục Quản lý Dược
|
|
|
2
|
Thuốc chứa hoạt chất thuộc Danh mục
thuốc không kê đơn (áp dụng
với các thuốc đề nghị xin xác nhận nội dung quảng cáo)
|
|
|
Căn cứ trên Thông tư số 07/2017/TT-BYT ban hành Danh mục thuốc không
kê đơn
|
|
|
3
|
Thuốc không thuộc trường hợp hạn chế sử
dụng hoặc sử dụng dưới sự giám sát của thầy thuốc theo khuyến cáo của cơ quan
nhà nước có thẩm quyền (áp dụng với các thuốc đề nghị xin xác nhận nội
dung quảng cáo)
|
|
|
Căn cứ dữ liệu thuốc đã có công văn
khuyến cáo của Cục Quản lý Dược
|
|
|
4
|
Giấy đăng ký lưu hành thuốc còn hiệu lực
tại thời điểm rà soát
|
|
|
Căn cứ Quyết định cấp giấy ĐKLH và
công văn duy trì hiệu lực giấy ĐKLH (nếu có)
|
|
|
|
|
|
III
|
Ý kiến tổng hợp nội
dung thẩm định và ý kiến đề xuất độc lập (nếu có) của chuyên viên thụ lý:
|
|
1
|
Ý kiến tổng hợp nội dung thẩm định
|
Ghi cụ thể nội dung tổng
hợp:
1. Tiểu ban Pháp chế
2. Tiểu ban Thông tin
sản phẩm
|
|
2
|
Ý kiến đề xuất độc lập (nếu có)
|
Ghi cụ thể nội dung đề
xuất độc lập (nếu có)
|
|
3
|
Đề xuất:
|
□ Đề xuất kết quả đánh giá hồ sơ (như mục IV bên dưới)
|
|
□ Đề xuất trao đổi lại với chuyên gia
(ghi rõ nội dung đề
xuất)
|
|
|
Ngày ...
tháng ... năm ...
Chuyên
viên thụ lý
(Ký)
(Họ
và tên chuyên viên thụ lý)
|
|
IV
|
Đề xuất kết quả đánh
giá hồ sơ của chuyên viên:
|
|
1
|
□ Cấp giấy xác nhận nội dung thông tin/quảng
cáo thuốc
|
|
|
2
|
□ Không cấp giấy xác nhận
nội dung thông tin/ quảng cáo thuốc
|
Ghi cụ thể lý do
không cấp
|
|
3
|
□ Hồ sơ cần sửa đổi, bổ sung (Chỉ áp dụng
đối với hồ sơ lần đầu)
|
Ghi cụ thể lý do yêu
cầu sửa đổi, bổ sung
|
|
V
|
Kết luận của Phòng
QLKD Dược
|
|
|
|
□ Cấp giấy xác nhận nội dung thông tin/quảng cáo thuốc
|
|
|
|
□ Không cấp giấy xác nhận nội dung
thông tin/ quảng cáo thuốc
|
Ghi cụ thể lý do
không cấp (tổng hợp từ mục 2 phần IV)
|
|
|
□ Hồ sơ cần sửa đổi, bổ sung (Chỉ áp dụng đối
với hồ sơ lần đầu)
|
Ghi cụ thể lý do yêu
cầu sửa đổi, bổ sung (tổng hợp từ mục 3 phần IV)
|
|
|
|
|
|
|
Ngày ...
tháng ... năm ...
Lãnh
đạo Phòng
(Ký)
(Họ
và tên Lãnh đạo Phòng)
|
Biểu
mẫu BM.KD.33.01/03: Công văn yêu cầu bổ sung, sửa đổi nội dung đề nghị xác nhận
nội dung thông tin/quảng cáo thuốc
|
BỘ Y TẾ
CỤC QUẢN LÝ DƯỢC
-------
|
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
|
|
Số: /QLD-KD
V/v
Thẩm định hồ sơ đề nghị cấp Giấy xác nhận nội dung thông tin/quảng cáo thuốc
|
Hà Nội, ngày tháng năm 20...
|
Kính gửi: Công ty/Văn
phòng đại diện...
(Địa
chỉ)
Ngày , Cục Quản lý Dược nhận
được hồ sơ số: đề nghị cấp Giấy xác nhận nội
dung thông tin/quảng cáo thuốc của Công ty/Văn phòng đại diện...
Căn cứ Nghị định số 54/2017/NĐ-CP của Chính phủ quy định chi tiết
một số điều và biện pháp thi hành Luật dược
ký ban hành ngày 08/5/2017;
Căn cứ Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa
đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm
vi quản lý nhà nước của Bộ Y tế;
Căn cứ biên bản thẩm định hồ sơ đề nghị
cấp Giấy xác nhận nội dung thông tin/quảng cáo thuốc , Cục Quản lý
Dược yêu cầu công ty bổ sung, sửa đổi những nội dung thông tin/quảng cáo thuốc
như sau:
-
-
-
Cục Quản lý Dược - Bộ Y tế thông báo để
Công ty/Văn phòng đại diện... biết và thực hiện.
|
Nơi nhận:
-
Như trên;
-
Cục trưởng (để b/cáo);
-
PCT. Lê Việt Dũng (để b/cáo);
-
Lưu: VT, KD.
|
TL. CỤC
TRƯỞNG
TRƯỞNG
PHÒNG QUẢN LÝ
KINH
DOANH DƯỢC
|
Biểu
mẫu BM.KD.33.01/04: Giấy xác nhận nội dung thông tin thuốc theo hình thức phát
hành tài liệu cho cán bộ y tế/quảng cáo thuốc (trừ trường hợp quảng cáo thuốc
theo phương tiện tổ chức hội thảo, hội nghị, sự kiện giới thiệu thuốc)
|
BỘ Y TẾ
CỤC QUẢN LÝ DƯỢC
-------
|
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
|
GIẤY XÁC NHẬN
NỘI DUNG THÔNG
TIN THUỐC(1)/QUẢNG CÁO THUỐC(2)
Tên Cơ quan xác
nhận: Cục Quản lý Dược - Bộ Y tế
Xác nhận nội dung thông tin thuốc(1)/quảng cáo thuốc(2):
|
STT
|
Tên thuốc
|
Số giấy đăng ký
lưu hành
|
|
1
|
|
|
|
2
|
|
|
Đơn đề nghị số:
Tên cơ sở đề nghị xác nhận:
Địa chỉ:
Hình thức thông tin thuốc(1)/Phương tiện quảng cáo(2):
Số giấy xác nhận: .../20.../XNTT/QLD(1)/.../20.../XNQC/QLD(2)
|
|
Hà Nội, ngày
...tháng...năm 20...
TUQ.
CỤC TRƯỞNG
TRƯỞNG PHÒNG QUẢN LÝ
KINH
DOANH DƯỢC
|
Ghi chú:
(1) Áp dụng đối với xác nhận nội dung
thông tin thuốc;
(2) Áp dụng đối với xác nhận nội dung quảng
cáo thuốc.
Biểu
mẫu BM.KD.33.01/05: Giấy xác nhận nội dung quảng cáo thuốc qua phương tiện hội
thảo, hội nghị, sự kiện giới thiệu thuốc
|
BỘ Y TẾ
CỤC QUẢN LÝ DƯỢC
-------
|
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
|
GIẤY XÁC NHẬN
NỘI DUNG QUẢNG
CÁO THUỐC QUA PHƯƠNG TIỆN HỘI THẢO, HỘI NGHỊ, SỰ KIỆN GIỚI THIỆU THUỐC
Tên cơ quan xác
nhận: Cục Quản lý Dược - Bộ Y tế
Xác nhận nội dung quảng cáo thuốc qua
phương tiện hội thảo, hội nghị, sự kiện giới thiệu thuốc:
|
STT
|
Tên thuốc
|
Số giấy đăng
ký lưu hành
|
|
1
|
|
|
|
2
|
|
|
Đơn đề nghị số:
Tên cơ sở đề nghị xác nhận:
Địa chỉ:
Số giấy xác nhận: .../20.../XNQC/QLD
Địa điểm tổ chức quảng cáo thuốc:
Thời gian tổ chức quảng cáo thuốc:
|
|
Hà Nội, ngày
...tháng...năm 20...
TUQ.
CỤC TRƯỞNG
TRƯỞNG PHÒNG QUẢN LÝ
KINH
DOANH DƯỢC
|
Lưu ý: Giấy xác nhận chỉ có giá trị đối
với thời gian, địa điểm tổ chức hội thảo và nội dung đã được xác nhận
Biểu
mẫu BM.KD.33.01/06: Công văn thông báo không xác nhận nội dung thông tin thuốc/quảng
cáo thuốc
|
BỘ Y TẾ
CỤC QUẢN LÝ DƯỢC
-------
|
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
|
|
Số: /QLD-KD
V/v
không xác nhận nội dung thông tin thuốc/quảng cáo thuốc
|
Hà Nội, ngày tháng năm 20...
|
Kính gửi: Công
ty/Văn phòng đại diện...
(Địa
chỉ)
Ngày , Cục Quản lý Dược nhận
được hồ sơ số đề nghị cấp Giấy xác nhận nội
dung thông tin thuốc/quảng cáo thuốc của Công ty/Văn phòng đại diện...
Căn cứ Nghị định số 54/2017/NĐ-CP của Chính phủ quy định chi tiết
một số điều và biện pháp thi hành Luật dược
ký ban hành ngày 08/5/2017;
Căn cứ Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa
đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm
vi quản lý nhà nước của Bộ Y tế;
Căn cứ biên bản thẩm định hồ sơ đề nghị
cấp Giấy xác nhận nội dung thông tin/quảng cáo thuốc , Cục Quản lý
Dược có ý kiến như sau:
-
- Vì vậy, Công ty không được thông tin
thuốc/quảng cáo thuốc theo nội dung mà
Công ty đăng ký với Cục Quản lý Dược nêu trên. Trường hợp Công ty muốn tiếp
tục thông tin thuốc/quảng cáo thuốc , đề nghị Công ty nộp
lại
hồ
sơ đề nghị cấp giấy xác nhận nội
dung thông tin thuốc/quảng cáo thuốc nêu trên.
Cục Quản lý Dược - Bộ Y tế thông báo để
Công ty biết và thực hiện đúng các quy định hiện hành.
|
Nơi nhận:
-
Như trên;
-
Cục trưởng (để b/cáo);
-
PCT. Lê Việt Dũng (để b/cáo);
-
Lưu: VT, KD.
|
TL. CỤC
TRƯỞNG
TRƯỞNG
PHÒNG QUẢN LÝ
KINH
DOANH DƯỢC
|
Biểu
mẫu BM.KD.33.01/07: Công văn thông báo không xác nhận nội dung thông tin thuốc/quảng
cáo thuốc do không đáp ứng yêu cầu bổ sung, sửa đổi nội dung thông tin thuốc/quảng
cáo thuốc
|
BỘ Y TẾ
CỤC QUẢN LÝ DƯỢC
-------
|
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
|
|
Số: /QLD-KD
V/v
không xác nhận nội dung thông tin thuốc/quảng cáo thuốc
|
Hà Nội, ngày tháng năm 20...
|
Kính gửi: Công
ty/Văn phòng đại diện...
(Địa
chỉ)
Ngày , Cục Quản lý Dược nhận
được công văn số đề ngày kèm hồ sơ bổ
sung hồ sơ số
đề
nghị cấp Giấy xác nhận nội dung thông tin thuốc/quảng cáo thuốc của Công ty/Văn
phòng đại diện...
Căn cứ Nghị định số 54/2017/NĐ-CP của Chính phủ quy định chi tiết
một số điều và biện pháp thi hành Luật dược
ký ban hành ngày 08/5/2017;
Căn cứ Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa
đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm
vi quản lý nhà nước của Bộ Y tế,
Cục Quản lý Dược thông báo:
- Công ty đã không sửa đổi, bổ sung theo
yêu cầu của Cục Quản lý Dược về nội dung thông tin thuốc/quảng cáo thuốc tại
công văn số ngày , cụ thể:
+ ...
+ ...
- Vì vậy, Công ty không được thông tin
thuốc/quảng cáo thuốc theo nội dung mà
Công ty đề nghị xác nhận với Cục Quản lý Dược nêu trên. Trường hợp Công ty muốn
tiếp tục thông tin thuốc/quảng cáo thuốc , đề nghị Công ty nộp lại
hồ sơ đề nghị cấp giấy xác nhận nội dung thông tin thuốc/quảng cáo thuốc nêu
trên.
Cục Quản lý Dược - Bộ Y tế thông báo để
Công ty biết và thực hiện đúng các quy định hiện hành.
|
Nơi nhận:
-
Như trên;
-
Cục trưởng (để b/cáo);
-
PCT. Lê Việt Dũng (để b/cáo);
-
Lưu: VT, KD.
|
TL. CỤC
TRƯỞNG
TRƯỞNG
PHÒNG QUẢN LÝ
KINH
DOANH DƯỢC
|
