Mẫu báo cáo tổng kết công tác dược và mỹ phẩm mới nhất? Tải về mẫu báo cáo? Thời hạn báo cáo là khi nào?
Mẫu báo cáo tổng kết công tác dược và mỹ phẩm mới nhất? Tải về mẫu báo cáo?
Mẫu báo cáo tổng kết công tác dược và mỹ phẩm của Sở Y tế là Biểu mẫu 01 ban hành kèm Quyết định 4369/QĐ-BYT năm 2019:
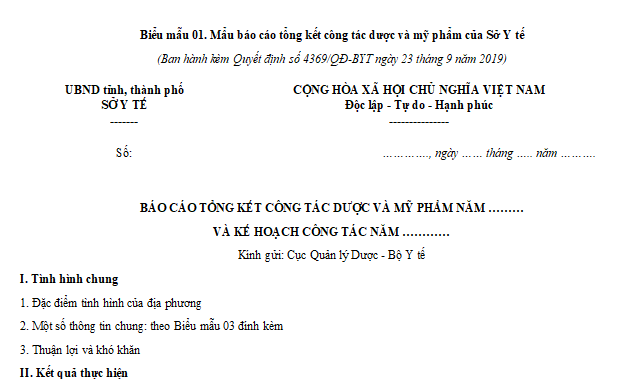
TẢI VỀ Mẫu báo cáo tổng kết công tác dược và mỹ phẩm

Mẫu báo cáo tổng kết công tác dược và mỹ phẩm mới nhất? Tải về mẫu báo cáo? (Hình từ Internet)
Thời hạn báo cáo tổng kết công tác dược và mỹ phẩm là khi nào?
Căn cứ Phần II Quy định về nội dung và thời gian kiểm tra, đánh giá việc thực hiện các quy định quản lý nhà nước về dược và mỹ phẩm ban hành kèm Quyết định 4369/QĐ-BYT năm 2019 có quy định về thời gian kiểm tra, đánh giá như sau:
II. Thời gian kiểm tra, đánh giá
1. Các đơn vị trực thuộc Sở Y tế, các cơ sở có hoạt động về dược và mỹ phẩm trên địa bàn tỉnh/thành phố trực thuộc Trung ương có trách nhiệm tiến hành tự kiểm tra đánh giá các mặt hoạt động có liên quan đến công tác dược, mỹ phẩm của đơn vị mình trên cơ sở hướng dẫn của Sở Y tế và báo cáo kết quả về Sở Y tế trước ngày 05/11 hàng năm.
2. Từ ngày 05/11 đến ngày 15/12 hàng năm, Sở Y tế tiến hành phúc tra kết quả tự kiểm tra đánh giá của các đơn vị thuộc Sở, các cơ sở có hoạt động về dược, mỹ phẩm trên địa bàn và tự đánh giá hoặc liên hệ với Sở Y tế khác để tiến hành đánh giá chéo kết quả công tác quản lý nhà nước về dược, mỹ phẩm trên địa bàn; tổng hợp, báo cáo kết quả tự đánh giá hoặc đánh giá chéo về Cục Quản lý Dược trước ngày 25/12 hàng năm theo Biểu mẫu 01 và Biểu mẫu 02 đính kèm. Trong quá trình phúc tra nếu phát hiện vi phạm thì lập Biên bản, xử lý hoặc chuyển hồ sơ cho cơ quan, cá nhân có thẩm quyền xử lý theo quy định.
3. Từ 01/01-30/4 của năm kế tiếp và căn cứ trên tình hình thực tế hoạt động của ngành, Cục Quản lý Dược tiến hành phúc tra kết quả tự kiểm tra có trọng tâm, trọng điểm một số Sở Y tế, tổng hợp, đánh giá công tác quản lý nhà nước về dược và mỹ phẩm để báo cáo Lãnh đạo Bộ Y tế. Trong quá trình phúc tra nếu phát hiện vi phạm thì lập Biên bản, xử lý hoặc chuyển hồ sơ cho cơ quan, cá nhân có thẩm quyền xử lý theo quy định./.
Theo đó, từ ngày 05/11 đến ngày 15/12 hàng năm, Sở Y tế có nhiệm vụ tiến hành phúc tra kết quả tự kiểm tra đánh giá của các đơn vị thuộc Sở, các cơ sở có hoạt động về dược, mỹ phẩm trên địa bàn và tự đánh giá hoặc liên hệ với Sở Y tế khác để tiến hành đánh giá chéo kết quả công tác quản lý nhà nước về dược, mỹ phẩm trên địa bàn.
Đồng thời, tổng hợp, báo cáo kết quả tự đánh giá hoặc đánh giá chéo về Cục Quản lý Dược trước ngày 25/12 hàng năm theo Biểu mẫu 01 và Biểu mẫu 02 đính kèm. Trong quá trình phúc tra nếu phát hiện vi phạm thì lập Biên bản, xử lý hoặc chuyển hồ sơ cho cơ quan, cá nhân có thẩm quyền xử lý theo quy định.
Nội dung kiểm tra, đánh giá việc thực hiện các quy định quản lý nhà nước về dược và mỹ phẩm gồm những gì?
Nội dung kiểm tra, đánh giá việc thực hiện các quy định quản lý nhà nước về dược và mỹ phẩm được quy định tại Phần I Quy định về nội dung và thời gian kiểm tra, đánh giá việc thực hiện các quy định quản lý nhà nước về dược và mỹ phẩm ban hành kèm Quyết định 4369/QĐ-BYT năm 2019, cụ thể như sau:
(1) Tại Sở Y tế:
- Công tác xây dựng chiến lược, quy hoạch, kế hoạch phát triển ngành tại địa phương và việc tổ chức triển khai thực hiện sau khi được phê duyệt;
- Công tác triển khai thực hiện các chính sách, chủ trương, đường lối quản lý, phát triển ngành dược, mỹ phẩm của nhà nước, Chính phủ hoặc của Bộ Y tế;
- Công tác tổ chức thực hiện, phối hợp triển khai thực hiện các văn bản quy phạm pháp luật và các quy định về quản lý nhà nước về dược, mỹ phẩm;
- Công tác triển khai các thủ tục hành chính liên quan đến lĩnh vực quản lý dược và mỹ phẩm thuộc phạm vi của Sở Y tế;
- Công tác tuyên truyền, phổ biến, hướng dẫn triển khai các văn bản quy phạm pháp luật về dược và mỹ phẩm mới ban hành;
- Công tác tổ chức và phối hợp liên ngành trong việc thanh tra, kiểm tra việc thực hiện các quy định quản lý nhà nước về dược và mỹ phẩm;
- Công tác chỉ đạo, kiểm tra các đơn vị thực hiện quy định về quản lý dược và mỹ phẩm theo từng lĩnh vực:
+ Quản lý chất lượng thuốc;
+ Quản lý thông tin, quảng cáo thuốc, và theo dõi phản ứng có hại của thuốc (DI & ADR);
+ Quản lý giá thuốc;
+ Quản lý kinh doanh dược;
+ Đăng ký thuốc;
+ Đấu thầu, cung ứng thuốc;
+ Quản lý dược bệnh viện;
+ Quản lý mỹ phẩm;
+ Công tác thanh tra dược và mỹ phẩm;
+ Việc ứng dụng Công nghệ thông tin kết nối cơ sở cung ứng thuốc.
- Công tác thống kê và tổng hợp, báo cáo;
- Công tác đào tạo nhân lực dược;
- Công tác cải cách hành chính.
(2) Tại Phòng Y tế:
- Công tác xây dựng kế hoạch hoạt động công tác dược hàng năm trình Ủy ban nhân dân có thẩm quyền phê duyệt và tổ chức triển khai thực hiện;
- Công tác tuyên truyền, phổ biến các văn bản quy phạm pháp luật về dược và mỹ phẩm mới ban hành;
- Công tác tổ chức thực hiện và phối hợp với các đơn vị thực hiện các văn bản quy phạm pháp luật và các quy định về quản lý dược và mỹ phẩm;
- Công tác tổ chức và phối hợp liên ngành trong việc thanh tra, kiểm tra việc thực hiện các quy định quản lý nhà nước về dược và mỹ phẩm;
- Công tác phối hợp với Sở Y tế trong việc thẩm định cấp chứng chỉ hành nghề, giấy chứng nhận đủ điều kiện kinh doanh dược cho các cơ sở kinh doanh dược theo thẩm quyền;
- Công tác thống kê và tổng hợp, báo cáo;
- Công tác cải cách hành chính.
Tại các địa phương nếu Ủy ban nhân dân quận, huyện giao cho Trung tâm Y tế quận, huyện thực hiện chức năng quản lý nhà nước về y tế trên địa bàn thì các nội dung này được áp dụng để kiểm tra tại các Trung tâm Y tế đó.
(3) Tại Trung tâm kiểm nghiệm:
- Công tác xây dựng kế hoạch kiểm tra, giám sát chất lượng thuốc và mỹ phẩm trên địa bàn;
- Công tác tổ chức triển khai thực hiện kế hoạch kiểm tra, giám sát chất lượng thuốc và mỹ phẩm trên địa bàn;
- Việc phối hợp với các cơ quan chức năng trong công tác kiểm tra, giám sát chất lượng thuốc và mỹ phẩm trên địa bàn;
- Việc thực hiện, duy trì đáp ứng các quy định của pháp luật về điều kiện hoạt động phù hợp với phạm vi hoạt động;
- Công tác nghiên cứu khoa học và ứng dụng khoa học kỹ thuật, áp dụng các nguyên tắc, tiêu chuẩn GLP, ISO.
- Công tác đào tạo cán bộ chuyên môn kỹ thuật và nghiên cứu khoa học phục vụ công tác kiểm nghiệm dược và mỹ phẩm;
- Công tác thống kê và tổng hợp báo cáo.
(4) Tại cơ sở sản xuất thuốc:
- Hồ sơ pháp lý: Giấy chứng nhận đủ điều kiện kinh doanh dược;
- Việc thực hiện các quy định chuyên môn về dược và quản lý giá thuốc;
- Việc thực hiện các nguyên tắc về thực hành tốt (GPs);
- Công tác kiểm tra, kiểm soát chất lượng và đảm bảo chất lượng thuốc;
- Việc ứng dụng CNTT kết nối cơ sở cung ứng thuốc;
- Công tác Đăng ký thuốc;
- Việc cập nhật thông tin thuốc theo yêu cầu của cơ quan quản lý;
- Việc thực hiện quy định của pháp luật trong việc kinh doanh thuốc và nguyên liệu làm thuốc phải kiểm soát đặc biệt;
- Công tác tổ chức và quản lý hoạt động của các đơn vị trực thuộc (nếu có): chi nhánh, nhà thuốc, quầy thuốc...
(5) Tại cơ sở bán buôn, xuất khẩu, nhập khẩu thuốc, nguyên liệu làm thuốc:
- Hồ sơ pháp lý: Giấy chứng nhận đủ điều kiện kinh doanh dược;
- Việc thực hiện các quy định chuyên môn về dược và quản lý giá thuốc;
- Việc thực hiện các quy định về nguyên tắc “Thực hành tốt bảo quản thuốc - GSP” và/hoặc “Thực hành tốt phân phối thuốc - GDP”;
- Công tác kiểm tra, kiểm soát chất lượng và đảm bảo chất lượng thuốc;
- Việc ứng dụng CNTT kết nối cơ sở cung ứng thuốc;
- Việc cập nhật thông tin thuốc theo yêu cầu của cơ quan quản lý;
- Việc kinh doanh thuốc, nguyên liệu làm thuốc phải kiểm soát đặc biệt;
- Công tác tổ chức và quản lý hoạt động của các đơn vị trực thuộc (nếu có): chi nhánh, nhà thuốc, quầy thuốc...
(6) Tại cơ sở làm dịch vụ thử thuốc trên lâm sàng, dịch vụ BA/BE
- Hồ sơ pháp lý: Giấy chứng nhận đủ điều kiện kinh doanh dược;
- Việc thực hiện các quy định về hoạt động thử thuốc trên lâm sàng.
(7) Tại cơ sở bán lẻ thuốc:
- Hồ sơ pháp lý: Giấy chứng nhận đủ điều kiện kinh doanh dược;
- Việc thực hiện các quy định chuyên môn về dược, quy chế kê đơn thuốc trong điều trị ngoại trú và quy định về quản lý giá thuốc;
- Việc thực hiện các quy định về nguyên tắc “Thực hành tốt nhà thuốc - GPP”;
- Công tác kiểm tra, kiểm soát chất lượng thuốc;
- Việc ứng dụng CNTT kết nối cơ sở cung ứng thuốc;
- Việc cập nhật thông tin thuốc theo yêu cầu của cơ quan quản lý;
- Việc thực hiện quy định của pháp luật trong việc kinh doanh thuốc, phải kiểm soát đặc biệt.
(8) Tại cơ sở làm dịch vụ bảo quản thuốc, nguyên liệu làm thuốc:
- Hồ sơ pháp lý: Giấy chứng nhận đủ điều kiện kinh doanh dược;
- Việc thực hiện các quy định chuyên môn về dược;
- Việc thực hiện các nguyên tắc về “Thực hành tốt bảo quản thuốc - GSP”;
- Việc ứng dụng CNTT kết nối cơ sở cung ứng thuốc;
- Việc cập nhật thông tin thuốc theo yêu cầu của cơ quan quản lý;
- Việc bảo quản thuốc, nguyên liệu làm thuốc phải kiểm soát đặc biệt.
(9) Tại cơ sở làm dịch vụ kiểm nghiệm thuốc, nguyên liệu làm thuốc:
- Hồ sơ pháp lý: Giấy chứng nhận đủ điều kiện kinh doanh dược;
- Việc thực hiện các quy định chuyên môn về dược;
- Việc thực hiện các nguyên tắc về “Thực hành tốt phòng kiểm nghiệm thuốc - GLP”.
(10) Công tác dược tại các cơ sở khám chữa bệnh:
- Công tác tiếp nhận, phổ biến và thực hiện các văn bản quản lý nhà nước về dược, các quy định chuyên môn về dược trong các cơ sở khám, chữa bệnh;
- Hoạt động của Hội đồng thuốc và điều trị;
- Công tác đấu thầu, cung ứng thuốc trong bệnh viện;
- Công tác quản lý, sử dụng thuốc tại cơ sở khám chữa bệnh;
- Công tác dược lâm sàng, thông tin thuốc và theo dõi phản ứng có hại của thuốc (DI&ADR);
- Việc thực hiện Quy chế kê đơn thuốc trong điều trị ngoại trú;
- Công tác pha chế thuốc theo đơn (nếu có);
- Việc thực hiện các nguyên tắc về “Thực hành tốt bảo quản thuốc - GSP”;
- Công tác kiểm tra, kiểm soát chất lượng thuốc;
- Công tác quản lý hoạt động của nhà thuốc bệnh viện.
(11) Các cơ sở có hoạt động dược nhưng không thuộc diện cấp giấy chứng nhận đủ điều kiện kinh doanh dược:
- Việc thực hiện các quy định chuyên môn về dược, quy chế kê đơn thuốc trong điều trị ngoại trú và quy định về quản lý giá thuốc;
- Việc thực hiện các quy định về nguyên tắc GPs;
- Công tác kiểm tra, kiểm soát chất lượng thuốc;
- Việc thực hiện các quy định về quản lý mỹ phẩm.
(12) Tại các cơ sở sản xuất mỹ phẩm:
- Hồ sơ pháp lý: Giấy chứng nhận đủ điều kiện sản xuất mỹ phẩm;
- Việc thực hiện các nguyên tắc về “Thực hành tốt sản xuất mỹ phẩm của ASEAN” (CGMP - ASEAN);
- Việc thực hiện các quy định về quản lý mỹ phẩm.
(13) Tại các cơ sở kinh doanh mỹ phẩm:
- Hồ sơ pháp lý: Giấy chứng nhận đăng ký kinh doanh;
- Việc thực hiện các quy định về quản lý mỹ phẩm.





Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.
- Mẹ nuôi lợi dụng việc nuôi con ép con nuôi ra đường xin ăn kiếm tiền thì có vi phạm pháp luật không?
- Doanh nghiệp để xảy ra sự cố tràn dầu mà không báo cáo kịp thời đến cơ quan có thẩm quyền bị xử phạt bao nhiêu?
- Tổ chức thẩm định giá báo cáo không đúng mẫu theo quy định về thẩm định giá sẽ bị xử phạt bao nhiêu?
- Doanh nghiệp phát hành hồ sơ mời thầu khi chưa đủ điều kiện sẽ bị xử phạt hành chính bao nhiêu?
- Công ty chứng khoán sử dụng thông tin nội bộ để mua bán chứng khoán cho chính mình có bị đình chỉ hoạt động kinh doanh chứng khoán không?










